影响盐类水解的因素
应用
(1)盐水解的规律:
①谁弱谁水解,谁强显谁性,越弱越水解,都弱都水解,无弱不水解
②多元弱酸根、正酸根离子比酸式酸根离子水解程度大得多,故可只考虑第一步水解
(2)具体分析一下几种情况:
①强碱弱酸的正盐:弱酸的阴离子发生水解,水解显碱性;如:Na2CO3、NaAc等
②强酸弱碱的正盐:弱碱的阳离子发生水解,水解显酸性;如:NH4Cl、FeCl3、CuCl2等;
③强酸强碱的正盐,不发生水解;如:Na2SO4、NaCl、KNO3等;
④弱酸弱碱的正盐:弱酸的阴离子和弱碱的阳离子都发生水解,溶液的酸碱性取决于弱酸和弱碱的相对强弱,谁强显谁性;
⑤强酸的酸式盐只电离不水解,溶液显酸性,如:NaHSO4;而弱酸的酸式盐,既电离又水解,此时必须考虑其电离和水解程度的相对大小:若电离程度大于水解程度,则溶液显酸性,如:NaHSO3、NaH2PO4;若水解程度大于电离程度,则溶液显碱性,如:NaHCO3、NaHS、Na2HPO4等。
(3)几种盐溶液pH大小的比较强酸强碱盐pH=7、强碱弱酸盐pH>7、强酸弱碱盐pH<7
根据其相应的酸的酸性大小来比较,盐溶液对应的酸的酸性越强,其盐溶液的pH越小如:HClO酸性小于H2CO3,溶液pH NaClO>Na2CO3
酸式盐溶液酸碱性的判断
酸式盐的水溶液显什么性,要看该盐的组成微粒。
1.强酸的酸式盐只电离,不水解,溶液一定显酸性。如 溶液:
溶液: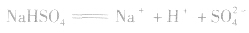
2.弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
(1)若电离程度小于水解程度,溶液显碱性。例如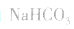 溶液中:
溶液中: 溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
溶液显碱性。NaHS溶液、Na2HPO4溶液亦显碱性
(2)若电离程度大于水解程度,溶液显酸性。例如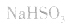 溶液中:
溶液中: 溶液显酸性
溶液显酸性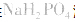 溶液亦显酸性。
溶液亦显酸性。
为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
①适量的HCl②适量的NaCl③适量的氨水④适量的NaOH,正确的是[ ]
A.①②
B.③
C.③④
D.④欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是 [ ] A.通入二氧化碳气体
B.加入氢氧化钠固体
C.通入氯化氢气体
D.加入饱和石灰水向三份0.1mol·L-1 CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 [ ] A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是 [ ] A.加水
B.加入氢氧化钠固体
C.通入氯化氢气体
D.加入饱和石灰水溶液向三份0.1mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 [ ] A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大在一定温度下,Na2CO3溶液中存在水解平衡:CO32-+H2O  HCO3-+OH-。下列说法中,正确的是
HCO3-+OH-。下列说法中,正确的是[ ] A.升高温度,  减小
减小
B.通入CO2,平衡向正反应方向移动
C.稀释溶液,Na2CO3水解程度增大,水解平衡常数增大
D.加入NaOH固体,平衡向逆反应方向移动,溶液pH减小在一定条件下Na2CO3溶液存在水解平衡:CO32++H2O  HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是 [ ] A.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(H+)
B.升高温度,平衡向正反应方向移动
C.稀释溶液,溶液中c(H+)和c(OH-)都减少
D.加入NaOH固体,溶液pH减小在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O  HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是[ ] A.稀释溶液,上述可逆反应平衡常数不变
B.通入CO2,溶液pH增大
C.加入NaOH固体,平衡向正反应方向移动
D.升高温度, 不变
不变 (1)工业上用氨和二氧化碳反应合成尿素。已知下列物质在一定条件下均能与水反应产生  。H2是合成氨的原料,
。H2是合成氨的原料, 供合成尿素用。若从充分利用原料的角度考虑,选用________(填序号)物质作原料较好.
供合成尿素用。若从充分利用原料的角度考虑,选用________(填序号)物质作原料较好.
A.CO B.石脑油( ) C.
) C. D.焦炭
D.焦炭
(2) 水解生成BiOCl沉淀.试回答下列问题:
水解生成BiOCl沉淀.试回答下列问题:
① 分解的反应方程式为____________________________________.
分解的反应方程式为____________________________________.
②医药上把BiOCl叫做交氯酸铋,分析这种名称是否合理:_______________.
③把适量的 溶于浓NaCl溶液中或溶于含有少量盐酸的水中都得到澄清溶液,试用平衡移动原理分析可能的原因____________________________________.
溶于浓NaCl溶液中或溶于含有少量盐酸的水中都得到澄清溶液,试用平衡移动原理分析可能的原因____________________________________. 为了配制NH4+浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入①适量的HCl②适量的NaCl③适量的氨水④适量的NaOH,正确的是 [ ]
A.①②
B.③
C.③④
D.④向三份0.1mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 [ ] A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大CH3COOH与CH3COONa等物质的量混合配制成稀溶液,PH为4.7,下列说法错误的是 [ ] A.CH3COOH的电离作用大于CH3COONa的水解作用
B.CH3COONa的水解作用大于CH3COOH的电离作用
C.CH3COOH的存在抑制了CH3COONa的水解
D.CH3COONa的存在抑制了CH3COOH的电离为配置NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入 [ ] ① 适量HCl ② 适量NaCl ③ 适量氨水 ④ 适量NaOH
A.①②
B.③
C.③④
D.④欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是 [ ]
A.通入二氧化碳气体
B.加入氢氧化钠固体
C.通入氯化氢气体
D.加入饱和石灰水溶液物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡,它们都可看作化学平衡的一种。请根据所学化学知识回答下列问题:
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为________________。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
____________________________________________________________。
(3)已知(NH4)2Fe(SO4)2溶于水全部电离成NH4+、Fe2+、SO42-,有相同浓度的(NH4)2Fe(SO4)2和
(NH4)2SO4溶液,在__________________溶液中NH4+浓度更大(填化学式),其原因是______________________________。
(4)AgCl在溶液中存在如下平衡:AgCl(s) Ag+(aq)+Cl-(aq),在25℃ 时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:① 100mL蒸馏水 ② 100mL 0.3mol·L-1 AgNO3溶液 ③ 100mL
Ag+(aq)+Cl-(aq),在25℃ 时,AgCl的Ksp=1.8×10-10。现将足量AgCl分别放入下列液体中:① 100mL蒸馏水 ② 100mL 0.3mol·L-1 AgNO3溶液 ③ 100mL
0.1 mol·L-1MgCl2溶液充分搅拌后冷却到相同温度,Ag+浓度由大到小的顺序为________________(填序号)。实验室配制硫酸铁溶液时,先把硫酸铁晶体溶解在稀硫酸中,再加水稀释至所需浓度,如此操作的目的是 [ ] A.防止硫酸铁分解
B.抑制硫酸铁水解
C.提高溶液的pH
D.提高硫酸铁的溶解度实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,其原因是______________________;配制完毕后要加入少量铁屑,其目的是_____________________。 把AlCl3溶液蒸干灼烧,最后得到的主要固体产物是_________________,为什么?___________________(用化学方程式和必要的文字说明)。 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化 
(1)甲同学认为,该溶液的pH值升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为________________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
__________(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(3)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则_________(填“甲”或“乙”)判断正确。试剂X是____________。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清石灰水
(4)将加热后的溶液冷却到10℃,若溶液的pH_______(填“高于”、“低于”或“等于”)8.3,则
_______(填“甲”或“乙”)判断正确。
(5)常温下,在测得PH都等于9的NaOH溶液和Na2CO3溶液中,由水电离的OH-浓度分别为amol/L和
bmol/L,则a与b的关系:________________。10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化 
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为____________________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
______________(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。丙认为:
(3)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则___________(填“甲”或“乙”)判断正确。试剂X是______________。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(4)将加热后的溶液冷却到10℃,若溶液的pH__________(填“高于”、“低于”或“等于”)8.3,则__________(填“甲”或“乙”)判断正确。
(5)查阅资料,发现NaHCO3的分解温度为150℃,丙断言__________(填“甲”或“乙”)判断是错误的,理由是______________________________。在下列平衡2CrO42-(黄色)+2H+  Cr2O72- (橙红色)+H2O中,某溶液颜色介于黄和橙红色之间,今欲使该溶液的橙红色加深,则要在溶液中加入
Cr2O72- (橙红色)+H2O中,某溶液颜色介于黄和橙红色之间,今欲使该溶液的橙红色加深,则要在溶液中加入 [ ]
A.H+
B.OH-
C.HCO3-
D.H2O现有学生做如下实验:将盛有滴加酚酞的0.1 mol/L NaHCO3溶液的试管微热时,观察到该溶液的浅红色加深;若冷却至室温时又变回原来的浅红色,发生该现象的主要原因是__________________________________________________________。(结合反应方程式说明) 在0.1 mol·L-1Na2CO3溶液中,欲使CO32-的浓度尽量接近0.1 mol·L-1,则应向溶液中加 [ ]
A.HCl
B.Na2CO3
C.NaCl
D.KOH在一定浓度的FeCl3溶液中,存在如下水解平衡:Fe3++3H2O  Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列哪个变化的说法正确
Fe(OH)3+3H+,在此溶液中滴入饱和的FeCl3溶液,下列哪个变化的说法正确[ ]
A.水解平衡向正反应方向移动
B.水解平衡向逆反应方向移动
C.溶液中H+浓度增大
D.Fe3+的水解程度增大恒温条件下,在CH3COONa稀溶液中分别加入少量下列物质:①固体NaOH;②固体KOH;③固体
NaHSO4;④固体CH3COONa;⑤冰醋酸。其中一定可使c(CH3COO-)/c(Na+)比值增大的是[ ]
A.①②
B.②⑤
C.①⑤
D.②④⑤下列关于FeCl3水解的说法错误的是 [ ]
A.水解达到平衡时(不饱和),加氯化铁达饱和溶液,溶液的酸性会增强
B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
C.有50℃和20℃的同浓度的两种FeCl3稀溶液,其他条件相同时,Fe3+的水解程度前者比后者小
D.为抑制Fe3+的水解,较好地保存FeCl3溶液,应加少量盐酸在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O  HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是[ ] A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡朝正反应方向移动
C.升高温度, 减小
减小
D.加入NaOH固体,溶液pH减小10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化 
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式:____________________。
(2)乙同学类比加热Ca(HCO3)2溶液,会出现___________________现象,认为NaHCO3溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断水解程度:Na2CO3_________NaHCO3(填“大于”或“小于”)
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则说明__________(填“甲”或“乙”)判断正确。试剂X是______________(填字母)
A. Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
②将加热后的溶液冷却到10℃,若溶液的pH________(填“高于”、“低于”或“等于”)8.3,则说明另一判断正确。氢氧化铝是两性氢氧化物,在水中存在着如下平衡:H++AlO2-+H2O  Al(OH)3
Al(OH)3 Al3++3OH-。向0.01 mol/L Al2(SO4)3溶液中逐滴滴加0.01 mol/L NaOH溶液至过量,滴加过程中的现象是:______________________________________________ 其反应的离子方程式是:___________________________
Al3++3OH-。向0.01 mol/L Al2(SO4)3溶液中逐滴滴加0.01 mol/L NaOH溶液至过量,滴加过程中的现象是:______________________________________________ 其反应的离子方程式是:___________________________(1)AgNO3的水溶液呈__________(填“酸”、“中”、“碱”)性, 原因是(用离子方程式表示):___________________;
(2)氯化铝水溶液呈__________性 ,(填“酸”、“中”、“碱”)性, 原因是(用离子方程式表示):________________________。 把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是_________。
(3)在配制硫化钠溶液时,为了防止发生水解,可以加入少量的_________________。25℃时,浓度均为0.2 mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是 [ ] A.均存在电离平衡和水解平衡
B.存在的粒子种类相同
C.c(OH-)前者大于后者
D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大向三份0.1 mol/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则
CH3COO-浓度的变化依次为[ ] A.减小、增大、减小
B.增大、减小、减小
C.减小、增大、增大
D.增大、减小、增大关于氯化铁水解的说法错误的是 [ ] A.水解达到平衡(不饱和)时,无论加氯化铁饱和溶液还是加水稀释,平衡均向正方向移动
B.浓度为5 mol/L和0.5 mol/L的两种FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
C.有50℃和20℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
D.为抑制Fe3+水解,较好地保存FeCl3溶液,应加少量盐酸10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化: 
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为________________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度_________(填“大于”或“小于”)NaHCO3。
(3)丙同学认为甲、乙的判断都不充分。丙认为:只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则_________(填“甲”或“乙”)判断正确。试剂X是_________(填序号)。
A.Ba(OH)2溶液 B.BaC12溶液 C.NaOH溶液 D.澄清的石灰水
将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则_____________ (填“甲”或“乙”)判断正确。现有浓度为0.1 mol·L-1的五种电解质溶液: ① Na2CO3 ② NaHCO3 ③ NaAlO2 ④ CH3COONa ⑤ NaOH
(1)这五种溶液的pH由小到大的顺序是_________(填编号);
(2)将五种溶液稀释相同的倍数时,其pH变化最大的是__________(填编号);
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
不考虑乙组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸_______________________; 乙组实验所得混合溶液中由水电离出的c (OH-)=_______mol/L。 求出该混合溶液中下列算式的值,要求写出推理、计算过程。
I.c (Na+)-c (A-):______________ ;
II.c (OH-)-c (HA):_________________________。10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化: 
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为_________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度___________(填“大于”或“小于”)NaHCO3。
丙同学认为甲、乙的判断都不充分。
(3)丙认为:
①只要在加热煮沸后的溶液中加入足量的试剂X,若产生沉淀,则_______(填“甲”或“乙”)判断正确。试剂X是_______(填序号)。
A.Ba(OH)2溶液
B.BaCl2溶液
C.NaOH溶液
D.澄清的石灰水
②将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则______(填“甲”或“乙”)判断正确。在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O  HCO3-+OH-。下列说法正确的是
HCO3-+OH-。下列说法正确的是[ ] A.稀释溶液,水解平衡常数增大
B.通入CO2,平衡朝正反应方向移动
C.升高温度, 减小
减小
D.加入NaOH固体,溶液pH减小下列叙述正确的是 [ ] A.0.1 mol/LC6H5ONa溶液中:c(Na+)>c(C6H5O-)>c(H+)>c(OH-)
B.Na2CO3溶液加水稀释后,恢复至原温度,pH和Kw均减小
C.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)不相等
D.在Na2S溶液中加入AgCl固体,溶液中c(S2-)下降对滴有酚酞试液的下列溶液,操作后颜色变深的是 [ ] A.明矾溶液加热
B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl
D.小苏打溶液中加入少量的NaCl固体下列说法正确的是 [ ] A.一定温度下,反应MgCl2(1) ==Mg(1)+ Cl2(g)的 △H>0,△S>0
B.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
NH3·H2O+H+达到平衡后,升高温度平衡逆向移动
C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D.对于反应2H2O2==2H2O+O2↑,加入MnO2或升高温度都能加快O2的生成速率用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是 [ ] A.20 mL 2 mol/L FeCl3溶液
B.40 mL 1 mol/L NaHCO3溶液
C.20 mL 1 mol/L Na2SO3溶液
D.40 mL 2 mol/L NH4HCO3溶液物质A--E都是由下表中的离子组成的,常温下各物质从1 mL稀释到1000 mL,pH的变化如甲图所示,其中A 与D反应得到E。请回答 

(1)根据甲图中各物质的pH变化关系,写出下列物质的化学式:B__________,D___________。
(2)甲图中a>9的理由是____________________。
(3)另取浓度为c1的B溶液25 mL,向其中逐滴滴加 0.2 mol/L的D溶液,滴定过程中溶液pH的变化曲线如 乙图所示。
①q为____________;
②G点溶液呈中性,则加入D溶液的体积V_________ (填“>”“<”或“=”)12.5 mL;
③常温下B、C溶液的pH分别是a、b且a +b=13,则将B、C混合恰好完全反应时所消耗B、C溶液的体积比 VB:VC=_____________。向10.00 mL 0.01 mol/L某一元酸HA溶液中逐滴加入0.01 mol/L NaOH 溶液,溶液pH变化曲线如图所示。下列说法不正确的是 
[ ] A.HA是弱酸
B.b点表示的溶液中:2c(Na+) = c(A-) + c(HA)
C.c点时:V= 10.00 mL
D.b、c、d点表示的溶液中:c(Na+) + c(H+) = c(A-) + c(OH-)
- 如图所示,宽度L=1m的足够长的U形金属框架水平放置,框架处在竖直向上的匀强磁场中,磁感应强度B=1T,框架导轨上放一根
- 阅读下面的文章,完成后面的问题。怀旧的成本韩少功①房子已建好了,有两层楼,七八间房,一个大凉台,地处一个三面环水的半岛上
- Audrey Hepburn is one of Hollywood’s all-time greatest actre
- 下列句子中没有语病的一句是( )A.近年来我国海域赤潮发生频率逐年增多,发生时间提前,3年间增加5倍之多。对沿海地区的
- 根据所给汉语提示完成下列句子.小题1:天黑了,请打开灯.It"s getting dark.Please
- 在天然物质里,________的硬度最大,在碳的单质中________有优良的导电性,________的分子具有足球结构
- “竹枪一支,打得妻离子散,未闻炮声震地;铜灯半盏,烧尽田地房廊,不见烟火冲天。” 对这句话理解正确的是 ( )A.揭示
- 如图所示,电源电压不变,R1=40Ω,R2=20Ω,I1=0.2A.求:(1) R2两端电压;(2)流过R2的电流;(3
- 如图,在ABCD中,对角线AC、BD 相交于O,AC+BD =18,BC=6,则△AOD 的周长为( )
- 化简:(1) (2)
- 一组数据-1,-2,x,1, 2的平均数为0,则这组数据的方差为( ).
- 某生物兴趣小组欲观察细胞减数分裂的过程。如果你是其中一员,请选择材料和试剂完成实验。(对实验时间和试剂用量不做具体要求)
- 已知命题:“直线a上的两个点A、B在平面α内.”与它不等价的命题是( )A.直线a在平面α内B.平面α通过直线aC.直
- (6分)应对校园暴力 共建和谐校园中学生张某在校常常炫耀自己的手机,同学王某向其索要,想玩几天。张某不给,两人争吵起来,
- 在距离地面高度等于地球半径的赤道上空,每日的昼长为A.12小时B.14小时C.20小时D.22小时
- 文学常识及名著阅读(6分)(1)“我记得当年玉帝妹子思凡下界,配合杨君,生一男子,曾使斧劈桃山的,是你么?我心要骂你几声
- 梁启超倡议建立“新史学”,“新”就新在①以历史进化论为指导 ②以国民群体为历史重心 ③以全体国民为读者对象 ④以“以
- 固定在竖直平面的光滑圆弧轨道ABCD,其A点与圆心O等高,D点为轨道最高点,DB为竖直直线,AC为水平线,AE为水平面。
- 用显微镜进行观察时,放大倍数最大的镜头组合是( )A.目镜5X,物镜10XB.目镜10X,物镜10XC.目镜5X,物镜
- 九年级学生小方被网络世界所吸引,不仅在家时整天沉迷于网络游戏,就连出门在外业常用手机上网玩游戏。为此,学习成绩急剧下降,
© 2017-2019 超级试练试题库,All Rights Reserved.
 Fe(OH)3+3H+,改变条件,填写下表。(填“增大”、“减小”或“不变”及“向左”、“向右”或“不移动”)
Fe(OH)3+3H+,改变条件,填写下表。(填“增大”、“减小”或“不变”及“向左”、“向右”或“不移动”)




