在某个容积为2.0L的密闭容器中,在T℃时按下图1所示发生反应:mA(g)+nB(g)pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).(1)图1
题型:不详难度:来源:
mA(g)+nB(g)
 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).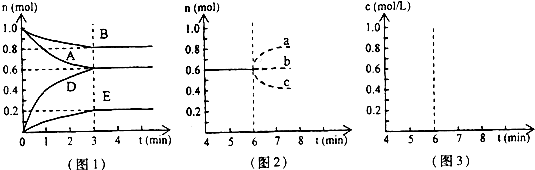
(1)图1所示,反应开始至达到平衡时,用D表示的平均反应速率为______.
(2)T℃时该反应的化学平衡常数K的数值为______.
(3)反应达到平衡后,第6min时:
①若升高温度,D的物质的量变化曲线最可能的是______(用图2中的a~c的编号作答);
②若在6min时仍为原平衡,此时将容器的容积压缩为原来的一半.请在图3中画出6min后B浓度的变化曲线______.
4)在T℃时,相同容器中,若开始时加入0.4molA、0.8molB、0.9molD和0.5molE0.5mol,反应达到平衡后,A的浓度范围为______.
(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是______.
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产品产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
答案
| ||
| 3min |
(2)物质的量的变化量之比等于化学计量数之比,所以(1.0-0.6)mol:(1.0-0.8)mol:0.6mol:0.2mol=m:n:p:q,即
m:n:p:q=2:1:3:1,所以方程式为2A(g)+B(g)
 3D(g)+E(s),所以平衡常数k=
3D(g)+E(s),所以平衡常数k=| c3(D) |
| c2(A)•c(B) |
| 0.6mol |
| 2L |
c(B)=
| 0.8mol |
| 2L |
| (0.3)3 |
| (0.3)2×0.4 |
(3)①该反应正反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应移动,D的浓度降低,所以升高温度,D的物质的量变化曲线最可能的是c,故答案为:c;
②由(2)知该反应反应前后气体体积不变,容器的容积压缩为原来的一半,压强增大1倍,平衡不移动,6min后B浓度为原来2倍,即0.8mol/L,所以6min后B浓度的变化曲线如图
 :
:
故答案为:
(4)开始加入0.4molA、0.8molB、0.9molD和0.5molE,此时的浓度商为
| (0.45)3 |
| (0.2)2×0.4 |
| 0.4mol |
| 2L |
开始加入0.4molA、0.8molB、0.9molD和0.5molE,按化学计量数转化到左边,可以等效为开始加入1molA、1.1molB、1和0.3molE,B的浓度比原平衡时大,平衡向正反应移动,所以平衡时A的浓度小于原平衡时浓度
| 0.6mol |
| 2L |
故答案为:0.2mol/L<c(A)<0.3mol/L;
(5)A.化学反应速率,表示反应快慢物理量,故A正确;
B.有效碰撞理论研究反应速率快慢,与转化率无关,故B错误;
C.勒夏特列原理是平衡移动原理,可指导怎样使用有限原料多出产品,故C正确;
D.催化剂的使用提高反应速率,不能改变产量,只能缩短到达平衡时间,故D错误;
E.综合经济效益既考虑原料的利用率又要考虑时间,故E正确;
故答案为:BD.
举一反三
工业上合成尿素是用CO2和NH3在一定条件下合成,其反应方程式为2NH3+CO2 CO(NH2)2+H2O,当氨碳比
CO(NH2)2+H2O,当氨碳比 ,CO2的转化率随时间的变化关系如图所示,下列说法错误的是( )
,CO2的转化率随时间的变化关系如图所示,下列说法错误的是( )

| A.该反应在60min时达到平衡状态 |
| B.NH3的平衡转化率为30% |
| C.增加氨碳比可进一步提高CO2的平衡转化率 |
| D.A点的逆反应速率υ逆(CO2)大于B点的正反应速率υ正(CO2) |
| 可逆反应:aA(g)+bB(g)═cC(g)+dD(g)根据图回答: ①压强P1比P2______(填大或小); ②(a+b)比(c+d)______(填大或小); ③温度t1℃比t2℃______(填高或低); ④正反应______热(填吸或放).  |
| (1)研究硫及其化合物性质有重要意义. 硫酸工业生产中涉及如下反应:2SO2(g)+O2(g)═2SO3(g).向2L的容器中充入2mol SO2、1mol O2,SO2的平衡转化率与温度的关系如图所示.T1温度时反应进行到状态D时,v(正)______v(逆)(填“>”、“<”或“=”).温度为T1时,反应的平衡常数K=______.(单位必须写),若在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2并使之重新达到平衡,测得又放出热量Q2.则下列说法正确的是______.(填字母编号) a.容器的压强增大原来的两倍b.Q2一定等于Q1 c.新平衡时SO2的转化率一定大于80% d.T3时的平衡常数大于T1时的平衡常数 (2)已知:25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp(MgF2)=7.4×10-11.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)______(填增大、减小或不变);在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是______(写化学式). (3)Al2(SO4)3溶液显示酸性,其原因是______(写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因:______. (4)加热蒸发下列溶液,能析出得到原溶质的是______. a.KNO3溶液b.AlCl3溶液c.Al2(SO4)3溶液d.盐酸 (5)25℃时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为______.  |
| 对于可逆反应A(g)+B(g)⇌C(g)(正反应为放热反应)来说,下列图象正确的是( ) |




