已知铜在常温下能被HNO3溶解.反应方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O(1)请将上述反应改成离子方程式______.(2)上述
题型:不详难度:来源:
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(1)请将上述反应改成离子方程式______.
(2)上述反应中,氧化剂是______,氧化产物是______.在反应的硝酸中没有参加氧化还原反应的硝酸占总硝酸的______.
答案
(2)在3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O反应中,Cu元素的化合价由0价升高为+2价,为还原剂,被氧化,氧化产物为Cu(NO3)2,HNO3中N元素的化合价由+5价降为+2价,被还原,为氧化剂,反应中产生Cu(NO3)2的HNO3没有参加氧化还原反应,没有参加氧化还原反应的硝酸占参加反应的全部硝酸的
| 6 |
| 8 |
故答案为:HNO3;Cu(NO3)2;75%.
举一反三
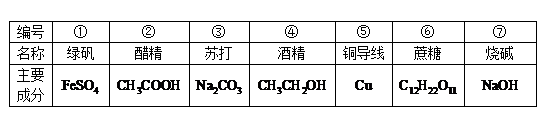
( 1)请你对表中①~⑦的主要成分进行分类(填编号)
属于盐的是______,属于电解质的是______,属于非电解质的是______.
(2)写出②与⑦反应的化学方程式______
过量盐酸与③反应的离子方程式为______
II.在NaI和H2SO4混合溶液中,加入H2O2水溶液,反应迅速发生,产生大量的气体,发生的反应有:
①H2O2+2NaI+H2SO4=I2+Na2SO4+2H2O
②H2O2+I2=2HIO
③H2O2+2HIO=I2+O2+2H2O
(1)H2O2在反应①中的作用是______,在③中的作用是______.
A.氧化剂
B.还原剂
C.既是氧化剂,又是还原剂
D.既不是氧化剂,也不是还原剂
(2)有人认为在反应②和③的总反应中,I2起催化剂的作用,你认为这种看法是否正确?______(填“正确”或“不正确”)
(3)H2O2,I2,HIO氧化性由强到弱的顺序是______.
(4)在①反应中,当有0.2mol氧化产物生成时,生成的还原产物是______mol.
A.MnO2+4HCl(浓)
| ||||
| B.Cl2+2NaOH=NaCl+NaClO+H2O | ||||
| C.5Cl2+I2+6H2O=10HCl+2HIO3 | ||||
| D.Cu(OH)2+2HCl═CuCl2+2H2O |
| A.NaCl、NaClO3 | B.NaClO3、NaClO4 |
| C.NaCl、NaClO | D.NaClO、NaClO3 |
| A.氧化还原反应的本质是化合价的升降,特征是电子的得失或电子对的偏移 | ||||
| B.一部分复分解反应可能是氧化还原反应 | ||||
C.在反应2H2O
| ||||
| D.在氧化还原反应中氧化剂得到电子发生氧化反应,还原剂失去电子发生还原反应 |
| A.溴离子具有氧化性 |
| B.氯气是还原剂 |
| C.该反应属于复分解反应 |
| D.氯气的氧化性比溴单质强 |
最新试题
- 关注中东问题,谈谈为什么犹太人和阿拉伯人都认为巴勒斯坦是他们的家园。根据历史地理知识分析为什么至今中东地区始终动荡不安。
- 美国心理学家卡耐基认为:一个人的成功30%靠才能,70%靠人际关系。在竞争日益激烈的今天,走出孤单,学会交往,对我们来说
- 已知原命题P:若(1)写出P的逆命题、否命题、逆否命题; (2)判断P的否命题的真假,并说明理由.
- 依次填入下面一段文字横线处的语句,衔接最恰当的一组是[ ] 今年夏天,天气异常闷热,_____________
- 已知圆C以C(t,2t)(t∈R,t≠0)为圆心且经过原点O.(Ⅰ)若直线2x+y-4=0与圆C交于点M,N,若|OM
- 在各项为正的等比数列中, ( )A.32B.C.64D.
- 下表是佳佳往妹妹家打长途电话的几次收费记载:(1)上表反映了哪两个变量之间的关系?哪个是自变量?哪个是因变量?(2)你能
- 某班5 位同学的身高( 单位:m) :为1.5 ,1.6 ,1.7 ,1.6 ,1.4 ,那么这组数据 [ ]
- 情景对话。 根据对话情景和内容,从对话后所给的选项中选出能填入空白处的最佳选项。— Good evening.
- 下列各句中,没有语病的一句是( )A.大家要继续解放思想,深化改革,面向现代化,面向世界,面向未来,在科研和教育战线
热门考点
- 第十二届全国人民代表大会的2987名代表的选举采取了间接选举和差额选举相结合的方式。这种选举方式( )①符合广大人民
- 已知(m-n)2=8,(m+n)2=2,则m2+n2=( )。
- 有学者认为:“与所谓‘器物—制度—文化’的三阶段说不同,近代中国人实际上经历的探索过程是‘西化’—‘反西化’—‘现代化’
- Ⅰ、如图所示实验中,如果镁条只与空气中的氧气反应,化学方程式为______,则进入集气瓶中水的体积最多不超过其容积的__
- “一战”后,主要由哪些战胜国瓜分了德国的全部海外殖民地[ ]A.英、法、日B.美、日、意C.英、法、美D.英、美
- 在社会主义社会,广大劳动人民成为国家、社会和自己命运的主人,这就为发挥其聪明才智提供了越来越多的社会条件。这表明( )
- 向50.0g8O%的氢氧化钠溶液中加入一定量的稀硫酸恰好完全反应,此时溶液pH=7.(1)求反应前氢氧化钠溶液中溶质的质
- 读某城市空间结构图,回答1~2题。 1.该城市的空间结构模式是 [
- I had a photo taken with him, ________ stood the famous towe
- 观察下图,请问以下哪条信息不能从图片中得出 [ ]A.皇帝至高无上B.丞相一人之下,万人之上C.县令由皇帝直
© 2017-2019 超级试练试题库,All Rights Reserved.