有关氧化还原反应的计算
计算
(1)比较典型的计算有:求氧化剂、还原剂物质的量之比或质量比,计算参加反应的氧化剂货还原剂的量,确定反应前后某一元素的价态变化等。
(2)计算的依据是:氧化剂得电子数等于还原剂失电子数,列出守恒关系式求解。
基本规律
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且失电子总数等于得电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且化合价升高总数必等于降低总数。有关得失电子守恒(化合价守恒)的规律有如下应用:
(1)求某一反应中被氧化与被还原的元素原子个数之比,或求氧化剂与还原剂的物质的量之比及氧化产物与还原产物的物质的量之比。
(2)配平氧化还原反应方程式。
(3)进行有关氧化还原反应的计算:
2.强弱规律
较强氧化性的氧化剂跟较强还原性的还原剂反应,生成弱还原性的还原产物和弱氧化性的氧化产物。应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。
3.价态规律
元素处于最高价,只有氧化性;元素处于最低价,只有还原性;元素处于中间价态,既有氧化性又有还原性,但主要表现一种性质。物质若含有多种元素,其性质是这些元素性质的综合体现。
4.转化规律
氧化还原反应中,以元素相邻价态之间的转化最容易;不同价态的同种元素之间发生反应,元素的化合价只靠近,不交叉;相邻价态的同种元素之间不发生氧化还原反应。
5.难易规律
越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,还原性最强的优先发生反应;同理,一种还原剂同时与多种氧化剂相遇时,氧化性最强的优先发生反应,如向FeBr2溶液中通入Cl2时,发生离子反应的先后顺序为: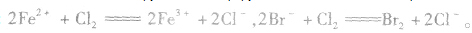 。
。
下列化学方程式书写完全正确的一组是 [ ] ①铁丝在氧气中剧烈燃烧:4Fe﹢3O2  2Fe2O3
2Fe2O3
②炽热的高炉中炭使二氧化碳还原:CO2﹢C 2CO
2CO
③氮肥碳酸氢铵与盐酸反应:NH4HCO3+2HCl=NH4Cl+CO2↑+H2O
④燃烧酒精:C2H5OH+3O2 3H2O+2CO2
3H2O+2CO2
A.①②
B.③④
C.①③
D.②④写出下列化学反应的方程式
(1)实验室制取二氧化碳的反应________________________,
(2)氯气与氢氧化钠反应________________________,
(3)氧化铝跟氢氧化钠溶液的反应(写离子反应方程式)________________________。
(4)漂白粉在空气中漂白原理________________________。下列表示溶液中发生反应的化学方程式错误的是 [ ] A.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
B.2KMnO4+HCOOK+KOH=2K2MnO4+CO2↑+H2O
C.MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
D.K2Cr2O7+6FeSO4+7H2SO4=Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O写成下列反应方程式
(1)Li与O2反应(点燃)______________________
(2)Na与O2反应(点燃)_____________________
(3)Na与H2O反应:_________________________
(4)K与H2O反应:_________________________写出下列反应方程式
卤素单质F2 、Cl2 、Br2 、I2与氢气反应___________________________、___________________________、___________________________、____________________________下列表示溶液中发生反应的化学方程式错误的是 [ ] A.2Al+2NaOH+2H2O=2NaAlO2+3H2 ↑
B.2KMnO4 +HCOOK+ KOH=2K2MnO4 +CO2↑+H2O
C.
D.K2Cr2O7 +6FeSO4 +7H2SO4=Cr2( SO4)3 +3Fe2(SO4)3+K2SO4 +7H2O我国是燃煤大国,治理燃煤产生的二氧化硫成为减少大气中二氧化硫含量和减轻酸雨危害的重要途径。下图所示为石灰石-石膏法脱硫示意图。请你写出由二氧化硫生成石膏主要成分的化学反应方程式:
(1)_____________________________________,
(2)_____________________________________。
下列表示工业生产主要反应的化学方程式正确的是 [ ] A.煅烧黄铁矿:2FeS2+5O2  2FeO +4SO2
2FeO +4SO2
B.高炉炼铁:Fe2O3 +3C 2Fe+3CO
2Fe+3CO
C.联合制碱法:NaCl+NH3+CO2+H2O=NaHCO3↓+ NH4Cl
D.工业法合成盐酸:H2+Cl2 2HCl
2HCl 能正确表示下列反应的化学方程式是 [ ] A. 黄铁矿煅烧:2FeS2+5O2  2FeO+4SO2
2FeO+4SO2
B. 石英与石灰石共熔:SiO2+CaO CaSiO3
CaSiO3
C. 氨的催化氧化:4NH3+5O2 4NO+6H2O
4NO+6H2O
D. 氯气与石灰乳反应:2Cl2+2Ca(OH)2=CaCl2+CaClO2+2H2O下列反应化学方程式表示不正确的是 [ ] A. 黄铁矿煅烧:2FeS2+5O2  FeO+4SO2
FeO+4SO2
B. 石英与石灰石共熔:SiO2+CaO CaSiO3
CaSiO3
C. 氨的催化氧化:4NH3+5O2 4NO+6H2O
4NO+6H2O
D. 氯气与石灰乳反应:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O多原子分子  的性质与卤素单质相似,故称它们为类卤素化合物,它们可以生成酸和盐,见下表:(表中X代表F、Cl、Br、I)
的性质与卤素单质相似,故称它们为类卤素化合物,它们可以生成酸和盐,见下表:(表中X代表F、Cl、Br、I) 
(1)在表中⑴ 、⑵、 ⑶处分别填写相应的化学式:________、_______、__________。
(2)完成下列化学方程式
① ___________________
___________________
②(CN)2与水反应的化学方程式为:________________________。
③KSCN与硫酸氢钠共热的化学方程式为:_________________________。请把符合要求的化学方程式的编号填入直线上。
(1)既属于分解反应又是氧化还原反应的是___________。
(2)属于化合反应,但不是氧化还原反应的是____________。
(3)既属于化合反应,又是氧化还原反应的是_____________。
(4)属于分解反应,但不是氧化还原反应的是____________。
(5)不属于四种基本反应类型的氧化还原反应的是____________。
A.2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
B.2Na+Cl2 2NaCl
2NaCl
C.Zn+CuSO4==ZnSO4+Cu
D.2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
E.CaO+CO2==CaCO3
F.4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2下列方程式不正确的是 [ ]
A.将CO2通入过氧化钠中:2Na2O2+2CO2= 2Na2CO3+O2
B.将SO2通入过氧化钠中:2Na2O2+2SO2=2Na2SO3+O2
C.将NO2通入过氧化钠中:Na2O2+2NO2=2NaNO3
D.将SO3的蒸气通入过氧化钠中:2Na2O2+2SO3= 2Na2SO4+O2物质X(□)和物质Y(○)的反应如下图所示: 对该反应的描述,下列反应方程式正确的是 
[ ]
A.3X +8Y =X3Y8
B.3X +8Y =3XY2 +2Y
C.3X +6Y =X3Y6
D.X +2Y =XY2下列反应的化学方程式书写正确的是 [ ]
A.Na在空气中燃烧:4Na+O2  2Na2O
2Na2O
B.Fe粉与水蒸气反应:2Fe+6H2O(g) 2Fe(OH)3 +3H2
2Fe(OH)3 +3H2
C.常温下N2与O2混合:N2+O2 =2NO
D.SO3与NaOH溶液反应:SO3+2NaOH= Na2SO4+ H2O单质、氧化物、酸、碱和盐的相互关系,可以用下图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)。 
①C+O2  CO2;
CO2;
②________
③________
④________
⑤________
⑥________
⑦________写出5个有CO2生成,且符合下列要求的化学方程式:
(1)一种盐分解___;
(2)一种金属氧化物跟单质反应___;
(3)一种非金属氧化物跟单质反应____;
(4)两种氧化物反应___;
(5)一种盐跟一种酸反应____下列化学反应方程式符合事实的是 [ ]
A.F2 +H2O=HF+HFO
B.2HCl+ Br2=2HBr+ Cl2
C.Fe+ Cl2 FeCl2
FeCl2
D.Br2 +2NaOH=NaBr+NaBrO+H2O用化学方程式表示下列反应,并注明反应属于四种基本反应类型中的哪一种。
(1)三氧化硫跟水反应
(2)加热高锰酸钾制氧气
(3)氧化铁跟盐酸反应
(4)氧化铜跟铝在高温下生成氧化铝和铜由溴乙烷可制备多种物质,请写出下列各步反应的化学方程式 
(1)______.
(2)______.
(3)______.
(4)______.
(5)______.用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式是( ) A.PbO B.Pb2O3 C.Pb3O4 D.PbO2 在一定条件下,完全分解下列某化合物2g,产生氧气1.6g,此化合物是( ) A.1
OH 162 B.2
OH 162 C.1
OH 182 D.2
OH 182 25°C和101kpa时,乙烷、乙炔和丙烯组成的混合烃32mL与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体的总体积缩小了72mL,原混合烃中乙炔的体积分数为( ) A.12.5% B.25% C.50% D.75% 将6.4g铜与100g98%H2SO4在烧瓶中加热发生反应.
(1)铜完全溶解后,计算生成的气体在标准状况下的体积是多少?
(2)将反应后烧瓶中的物质配成500mL溶液.
①在配制过程中用到的仪器有______;配制溶液时,若稀释后立即转移并定容,则所配得的溶液浓度______(填“偏大”“偏小”或“不变”).
②求所配得溶液中H2SO4的物质的量浓度.取50.0毫升Na2CO3和Na2SO4的混和溶液,加入过量BaCl2溶液后得到14.51克白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66克,并有气体放出.试计算:
(1)原混和溶液中Na2CO3和Na2SO4的物质的量浓度;
(2)产生的气体在标准状况下的体积.将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( ) A.0.05mol B.1mol C.1.05mol D.0.13mol 往100mL 1mol/L的AlCl3溶液中滴加1mol/L的NaOH溶液,得到5.85g沉淀,则加入NaOH溶液的体积可能是( ) A.200mL B.225mL C.300mL D.325mL 将19.5g锌加入到200ml 2mol-L-1的盐酸中,当反应结束后,试求:
(1)生成ZnCl2的物质的量;
(2)生成的氢气在标准状况下的体积.无色气体A在一种黄绿色气体B中可以安静的燃烧,发出苍白色火焰,反应生成气体C.B与金属D反应可生成白色固体E,D在空气中燃烧生成浅黄色固体F,F与CO2反应可得到气体G,D与水反应可生成A,A在G中燃烧生成水.推断出各种物质后,回答下列问题:
(1)写出下列物质的化学式:B______、C______、E______.
(2)写出下列化学方程式
a.由D生成F:______;
b.F与CO2反应:______;
c.D与水反应:______.过氧化钙是一种安全无毒的物质,带有数量不等的结晶水,通常还含有部分氧化钙.
(1)称取0.542g过氧化钙样品,灼热时发生如下反应:
2(CaO2-xH2O)
2CaO+O2↑+2xH2O,得到的O2在标准状况下体积为67.2ml.该样品中CaO2的物质的量为______.△
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.70g.
①试计算样品中CaO的质量.
②试计算样品中CaO2-xH2O的x值.标准状况下的HCl气体4.48L溶于水形成100ml溶液,然后与足量的铁屑充分反应.计算:
(1)所得盐酸的物质的量浓度;
(2)生成H2的体积;
(3)将生成的FeCl2配成400ml溶液,此溶液中FeCl2的物质的量浓度是多少?有NaCl、CaCl2、AlCl3三种溶液,若溶质的物质的量相等,分别与足量的硝酸银溶液反应,则生成沉淀的物质的量之比为______.若生成的沉淀的质量相等,则三种溶液中溶质的物质的量之比为______. 现用Zn与实验室中的盐酸反应制取4.48LH2(标准状况)
(1)如果选用所贴标签为2.0mol/L的盐酸,至少需要盐酸多少毫升?
(2)如果选用所贴标签为7%(密度为1.043g/mL)的盐酸,至少需要盐酸多少毫升?把少量金属钠投入下列溶液中,写出有关反应的化学方程式:
(1)钠投入稀盐酸中______.
(2)钠投入硫酸铜溶液中______.已知过氧化钠能与水发生如下反应:2Na2O2+2H2O═4NaOH+O2↑,7.8g过氧化钠与足量水反应后,将会产生多少摩尔NaOH,生成的O2在标准状况下所占的体积是多少? 简要回答下列问题.
(1)“可燃冰”是天然气的水合物,外形似冰,它的主要可燃成分是甲烷,写出甲烷燃烧的化学方程式______.
(2)氢氧化铝Al(OH)3是一种治疗胃酸(含盐酸)过多的药物,请用化学方程式表示该反应的原理:______.
(3)蒸馒头时,经常往蒸笼中放入小苏打,使得馒头膨松,食用起来香甜可口,请写出其原因:______.现用氯气与氢氧化钠溶液反应,若耗用的氯气为4.48L (标准状况).
(1)该反应的离子方程式为______.
(2)则选用所贴标签为2.0mol-L-1的氢氧化钠,至少需该氢氧化钠溶液______毫升.
(3)如选用所贴标签为10%(密度为1.043g-mL-1)的盐酸中和上述反应中所消耗的氢氧化钠,至少需该盐酸______毫升(保留小数点后一位).A、B两种有机化合物,当混合物质量一定时,无论A、B以何种比例混合,完全燃烧时产生的CO2的量均相等,肯定符合上述条件的可能是①同分异构体;②同系物;③具有相同的最简式;④含碳的质量分数相同( ) A.①③④ B.①③ C.①②③④ D.①②④ 等质量的下列烃完全燃烧,消耗O2最多的是( ) A.C3H6 B.C2H6 C.C6H6 D.C3H8 写出下列化学反应的方程式.
(1)写出乙烯和溴水发生反应的化学方程式______.
(2)氧化铝跟氢氧化钠溶液的反应(写离子反应方程式)______.有某硫酸铜、硫酸亚铁、硫酸铁的混合溶液100mL,已知溶液中各种阳离子的物质的量相等,硫酸根离子的浓度为7mol/L.此溶液最多能溶解铁粉的质量为( ) A.16.8g B.11.2g C.10.6g D.5.6g 煤中硫元素的质量分数为1%,假设煤燃烧时,煤中的硫全部转化为SO2.
(1)试计算燃烧64kg 煤,产生的SO2的物质的量是______mol.
(2)为减少煤燃烧产生的SO2对大气造成的污染,请你提出两条合理措施:
______;
______.工业上以CaO和HNO3为原料制备Ca(NO3)2-4H2O晶体.为确保制备过程中既不补充水分,也无多余的水分,所用硝酸溶液中溶质的质量分数应为( ) A.30% B.63% C.70% D.无法计算 在温度压强不变时,1mol NO2高温分解,生成NO和O2,达到平衡时容器内气体的物质的量变为1.2mol,这时NO2的转化率为( ) A.10% B.20% C.40% D.50% 按要求完成下列问题
(1)写出下列有机物的键线式:(CH3CH2)2CHCOOH______;
(2)分子式为C6H12的某烯烃,所有的碳原子都在同一平面上,则该烯烃的结构简式为______
(3)写出合成纤维素硝酸酯的化学反应方程式______
(4)已知1g氢气完全燃烧生成水蒸气时放出热量121kJ,且氧气中1mol O=O键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为______.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则( ) A.反应过程中得到6.72 L的气体(标况) B.最终得到的溶液中c(Na+)=c(Cl-)+c(OH-) C.最终得到7.8 g的沉淀 D.最终得到的溶液中c(NaCl)=0.15 mol/L 一定量的乙烷在氧气不足的情况下燃烧,得到CO、CO2和H2O的总质量为55.2g,若将产物通过浓H2SO4,浓H2SO4增重21.6g,则产物中CO的质量为( ) A.2.8g B.4.4g C.5.6g D.8.8g 下列物质中与相同物质的量的乙炔充分燃烧所消耗O2的量相等的是( ) A.乙烷 B.乙烯 C.乙醇 D.乙醛
- 的最大值是( )A.B.C.D.
- 超导材料为具有零电阻及反磁性的物质,以 Y2O3 等化合物为原料经研磨、烧结可合成一高温超导物质 YBa2Cu3O7,其
- 一束光线射在平面镜上,与镜面的夹角为30°,则反射光线跟入射光线的夹角为( )A.60°B.90°C.120°D.15
- 下列关于O2气体的制取、收集、临时存放的实验装置中,正确的是( )A.②④⑤B.②④⑥C.①⑤⑥D.②③⑤
- α,β为锐角,sinα=13,cos(α-β)=33,则cosβ=( )A.69B.63C.69或63D.223
- Most Chinese people these days know what it is like to have
- 下列有关文学常识的表述不正确的一项是[ ]A、我国文学史向来以“风***”并称,“风”指的是《诗经》中的“国风”,“
- 红军第五次反“围剿”失利的主要原因是[ ]A.红军力量不够强大B.博古等人军事指挥错误 C.武器装备差D.根据地
- 现代文阅读。
- 下列对自然增长率的描述,正确的是( )A.出生率减死亡率B.出生人口数减总人口数C.死亡率减出生率D.自然增长人口数减
- 下列句子中,没有语病的一句是 ( )A.人们被笼统地
- 王安石变法的失败说明宋朝A.地主阶级和农民的矛盾十分激烈B.统治阶级内部的矛盾十分激烈C.中央和地方的矛盾十分激烈D.各
- —What did your teacher say to you? —He said _________.[
- 某人欲估算飞机着陆时的速度,他假设飞机停止运动前在平直跑道上做匀减速运动,飞机在跑道上滑行的距离为x,从着陆到停下来所用
- He tried to deal with the ever-increasing burden of his work
- Chinese International SchoolApplication FormBefore an applic
- The soldier was _____of running away when the enemy attache
- 汽车在行驶中,由于路况和车速的不同,发动机的实际功率也不同,通常行驶时,实际功率要小于它的最大功率.某型号轿车的有关数据
- (15分)【中外历史人物评说】阅读下列材料,回答问题。材料一 私人企业和私人的主动性应该成为“国家主义”的基础。然而,鉴
- 在师生交往过程中,对于老师的错误,我们应该[ ]①老师也是人,犯错误不可避免②用适当的方式指出老师的错误③不分时间
© 2017-2019 超级试练试题库,All Rights Reserved.




