化学反应速率
定义
化学反应速率是用来衡量化学反应进行的快慢程度的物理量。
表示方法
在容积不变的反应器中,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。即: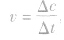
注意事项
(1)化学反应速率是指一段时间内的平均速率,而不是瞬时速率;通常前一段时间的平均反应速率要快于后一段时间的平均反应速率,反应速率均取正值,即v>0。
(2)在一定温度下,固体和纯液体物质单位体积的物质的量保持不变,即物质的量浓度为常数,因此在表示化学反应速率时,不代入固体或纯液体物质的浓度。浓度是指气体或溶液的浓度。
(3)同一个化学反应在相同的条件下、在同一段时间内,用不同物质表示反应速率时,数值可能相同也可能不同,但表达的意义都相同,即反应的快慢程度是一样的。
(4)在同一反应巾用不同的物质来表示反应速率时,其数值之比等于化学方程式中各物质的化学计量数之比.
相关试题
某反应在催化剂的作用下,按以下两步进行,第一步:X+Y=Z;第二步:Y+Z=M+N+X。此反应总的化学方程式是____________________,反应的催化剂是___________。 反应速率v和反应物浓度的关系是用实验方法测定的。化学反应H2+Cl2 =2HCl的反应速率v可表示为v= k[c(H2)]m.[c(Cl2)]n,式中k为常数,m、n值可用下表中的数据确定。 由此可推得m、n的值正确的是 
[ ] A.m=1.n=1
B.m= .n=
.n=
C.m= ,n=1
,n=1
D.m=1,n=
下列关于化学反应速率的说法中,正确的是 [ ] A.化学反应速率通常表示一定时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加
B.化学反应速率为0.8 mol/(L·s)是指1秒钟时某物质的浓度为0.8 mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越快,反应现象就越明显以下是几位同学在学习化学反应速率和化学平衡理论后发表的看法,其中不正确的是 [ ] A.化学反应速率理论可指导怎样在一定时间内快出产品
B.化学平衡理论可指导怎样使用有限原料多出产品
C.化学反应速率理论可指导怎样提高原料的转化率
D.正确利用化学反应速率和化学平衡理论可提高化工生产的综合经济效益某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析: 
(1)该反应的化学方程式:_____________________;
(2)反应开始至2min末,X的反应速率为_____________(mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是____________________________。下列关于反应速率的说法中,错误的是 [ ] A.反应速率用于衡量化学反应的快慢
B.决定反应速率的主要因素是反应物的性质
C.可逆反应达到化学平衡时,正、逆反应速率都为0
D.增大反应物浓度,提高反应物温度都能增大反应速率下列关于化学反应速率的说法中,不正确的是 [ ] A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示
C.在同一个反应中,各物质的反应速率之比等于化学方程式中的计量数之比
D.化学反应速率的常用单位有mol/(L·s)和mol/(L·min)下列关于化学反应速率的说法正确的是 A.化学反应速率指单位时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加
B.化学反应速率为0.8mol /(L·s)是指1s 时某物质的浓度为0.8mol/L
C.根据同一物质化学反应速率的大小可以知道化学反应进行的快慢
D.决定反应速率的主要因素是反应物的浓度下列关于化学反应速率的说法正确的是 [ ] A.化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加
B.化学反应速率为0.8mol/(L·s)表示的意思是:时间为1s时,某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显下列关于化学反应速率的说法中正确的是 [ ] A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率通常用单位时间内任何一种反应物浓度的增加或生成物浓度的减少来表示
C.若某化学反应的反应速率为0.5mol·(L·s)-1就是指在该时间内反应物和生成物的浓度变化都为
0.5mol·L-1
D.化学反应速率用于衡量化学反应进行的快慢下列关于化学反应速率的说法中,正确的是 [ ] A.化学反应速率通常表示一定时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加
B.化学反应速率为0.8mol/(L·s)是指1秒钟时某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越快,反应现象就越明显下列关于化学反应速率的说法,不正确的是 [ ] A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.单位时间内某物质的浓度变化越大,则该物质反应就越快
C.化学反应速率可以用单位时间内生成某物质的质量的多少来表示
D.化学反应速率常用单位有mol·L-1·s-1和mol·L-1·min-1下面四个选项是四位同学在学习过化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,其中,你认为不正确的是 [ ] A.化学反应速率理论可指导怎样在一定时间内快出产品
B.化学平衡理论可指导怎样使用有限原料多出产品
C.化学反应速率理论可指导怎样提高原料的转化率
D.正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益下列关于化学反应速率的说法正确的是 [ ] A.化学反应速率是指一定时间内任何一种反应物浓度的减少或者任何一种生成物浓度的增加
B.化学反应速率为0.8mol/(L·s)表示的意思是:时间为1s时,某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显下列关于化学反应速率公式v=kcp(A)cq(B)的叙述中,正确的是 [ ] A.对于化学反应,k是数值和单位都不变的常数
B.p、q就是化学方程式中A和B系数
C.对于特定的化学反应,k与所有外界条件都无关
D.化学反应速率公式v=kcp(A)cq(B)需要通过实验数值来确定,不能直接由方程式推得本题列举的四个选项是4位同学在学习“化学反应速率和化学平衡”专题后,联系工业生产实际所发表的观点,你认为不正确的是 [ ] A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品下列关于化学反应速率的说法正确的是 [ ] A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为0.8mol/(L·s)是指1s时某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应速率的快慢
D.对于任何化学反应来说,反应速率越大,反应现象就越明显下列关于化学反应速率的说法正确的是 [ ] A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为0.8 mol·L-1·s-1是指1 s时某物质的浓度为0.8 mol·L-1
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象就越明显下列关于化学反应速率的说法正确的是 [ ] A.化学反应速率是指一定时间内任何一种反应物的物质的量的减少或任何一种生成物的物质的量的增加
B.化学反应速率为0.8mol/L/s是指1秒钟时某物质的浓度为0.8mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何一个化学反应,反应速率越快,反应现象越明显下面有关化学反应速率的说法中正确的是 [ ] A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率通常用单位时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加来表示
C.若某化学反应的反应速率为0.5mol/(L·S)就是指在该时间内反应物和生成的浓度变化都为0.5mol/(L·s)
D.化学反应速率是用来衡量化学反应进行快慢的尺度下列关于化学反应速率的说法中,正确的是 [ ] A.化学反应速率通常表示在一定时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加
B.化学反应速率为0.8 mol/(L·s)是指1s时某物质的浓度为0.8 mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越快,反应现象就越明显反应N2(g)+3H2(g)  2NH3(g) ΔH<0,在某一时间段中反应速率与反应过程的曲线如下图所示,则NH3的百分含量最低的一段时间是
2NH3(g) ΔH<0,在某一时间段中反应速率与反应过程的曲线如下图所示,则NH3的百分含量最低的一段时间是
[ ] A.t0~t1
B.t2~t3
C.t3~t4
D.t5~t6下列关于化学反应速率的说法中,正确的是 [ ] A.化学反应速率通常表示在一定时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加
B.化学反应速率为0.8 mol/(L·s)是指1s时某物质的浓度为0.8 mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越快,反应现象就越明显对于反应:CaCO3+2HCl=CaCl2+ H2O+CO2↑,下列说法正确的是 [ ] A.用HCl和CaCl2表示的反应速率数据不同,但所表示的意义相同
B.不能用CaCO3的浓度变化来表示反应速率,但可用水来表示
C.用H2O和CO2表示的化学反应速率相同
D.用CaCl2浓度的减小表示其反应速率亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
_____Na2SO3+____KIO3+____ H2SO4=____Na2SO4 +_____K2SO4+____ I2 +_____H2O
(1)配平上面的氧化还原反应方程式,将化学计量数填在空白处。
(2)其中氧化剂是_______,若反应中有5mol电子转移,则生成碘_______mol。
(3)该反应过程和机理较复杂,一般认为分以下①~④步反应:
①IO3-+SO32- =IO2-+SO42- (反应速率慢)
②IO2-+2SO32- =I-+2SO42- (反应速率快)
③5I-+6H++IO3-=3I2+3H2O (反应速率快)
④I2+SO32- +H2O=2I-+SO42- +2H+ (反应速率快)
根据上述条件推测,此反应总的反应速率由__________步反应决定(填上述四步反应的序号)。
(4)若预先加入淀粉溶液,由题述看必须在___________离子消耗完时,才会有使淀粉变蓝的现象产生。下列关于化学反应速率的说法正确的是 [ ] A.化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加
B.化学反应速率为“0.8 mol/(L s)”所表示的意思是时间为1 s时,某物质的浓度为0.8 mol/L
s)”所表示的意思是时间为1 s时,某物质的浓度为0.8 mol/L
C.根据化学反应速率的大小可以知道化学反应进行的快慢
D.对于任何化学反应来说,反应速率越大,反应现象越明显下列关于化学反应速率的说法中正确的是 [ ] A.对任何化学反应来说,反应速率越大,反应现象就越明显
B.化学反应速率通常用单位时间内任何一种反应物浓度的增加或生成物浓度的减少来表示
C.若某化学反应的反应速率为0.5mol·(L·s)-1就是指在该时间内反应物和生成物的浓度变化都为
0.5mol·L-1
D.化学反应速率用于衡量化学反应进行的快慢下列关于化学反应速率的说法错误的是 [ ] A.化学反应速率是用于衡量化学反应进行快慢的物理量
B.决定化学反应速率的主要因素是反应物本身的性质
C.可逆反应达到化学平衡状态时,反应停止,正、逆反应速率都为零
D.增大反应物浓度或升高反应温度都能加快化学反应速率下列关于化学反应的速率和限度的说法正确的是 [ ] A.化学反应速率通常只能用反应物浓度的减少量表示
B.影响化学反应速率的条件并不只是温度和催化剂
C.化学平衡状态指的是反应物和生成物 浓度相等时的状态
D.催化剂既能加快化学反应速率,又能提高原料利用率或转化率反应A+3B=2C+2D.在四种不同的情况下的反应速率分别为:
①υ(A)=0.15mol/(L-s) ②υ(B)=0.6mol/(L-s)
③υ(C)=0.4mol/(L-s) ④υ(D)=0.45mol/(L-s)
该反应进行的快慢顺序为(用序号表示)______.反应:2A+B═2E经过一段时间后,E的浓度增加了0.4mol/L,在这段时间内用E表示的反应速率为0.04mol/(L.S),则这段时间为( ) A.2S B.2.5S C.5S D.10S 在一定条件下,向体积为2L的容器中加入2mol O2和3mol SO2进行可逆反应:
2SO2(l)+O2(l)
2SO3(l),2min后测得O2的物质的量为1.6mol,则:
(1)2min内,SO2的物质的量减少了______,SO3的物质的量增加了______;
(2)若用O2的浓度变化来表示该反应的反应速率,则V(O2)=______;
(3)若用SO3的浓度变化来表示该反应的反应速率,则V(SO3)=______.某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( ) A.0.04 B.0.04mol/(L.s) C.0.08mol/(L.s) D.0.04mol/L 四位同学同时进行反应:A(g)+3B(g)=2C(g)+2D(g) 的速率测定实验,分别测得反应速率如下:
①v(A)=0.15mol/(L-s)②v(B)=0.6mol/(L-s) ③v(C)=0.4mol/(L-s)④v(D)=0.45mol/(L-s).
其中,反应进行得最快的是( )A.① B.② C.③ D.④ 在一密闭容器中充入一定量的N2和H2,经测定反应开始后的2s内氢气的平均速率:ν(H2)=0.45mol/(L-s),则2s末NH3的浓度为( ) A.0.45mol/L B.0.50mol/L C.0.55mol/L D.0.60mol/L 已知4NH3(g)+5O2(g)═4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为( ) A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O) C.2v(NH3)=3v(H2O) D.4v(O2)=5v(NO) 对于化学反应:CaCO3+2HCl=CaCl2+CO2+H2O,下列说法正确的是( ) A.用HCl和CaCl2在单位时间内浓度变化表示的反应速率数据不同,但所表示的意义相同 B.不能用CaCO3的浓度变化来表示反应速率,但可用水来表示 C.用H2O和CO2表示的化学速率相同 D.可用CaCl2浓度的减少表示其反应速率 在体积为1L的密闭容器中,进行如下化学反应:CO2(g)+H2(g) 
CO(g)+H2O(g),反应焓变为△H,其化学平衡常数K和温度t的关系如下表:T℃ 700 800 850 1000 1200 K 0.6 0.9 1.0 1.7 2.6 向一体积不变的密闭容器中加入2mol A、0.6mol C和一定量的B三种气体.一定条件下发生反应,各物质浓度随时间变化如图一所示.图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件.已知t3~t4阶段使用了催化剂;图一中t0~t1阶段c(B)未画出. 
(1)若t1=15min,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=______.
(2)t4~t5阶段改变的条件为______,B的起始物质的量为______.
(3)判断图一中可逆反应达到平衡状态的依据是(填序号)______.
①2v正(A)=3v逆(C)
②混合气体的密度不变
③混合气体的平均相对分子质量不变
④A、B、C的浓度都不再发生变化
(4)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式:______.
(5)在相同条件下,若起始时容器中加入a mol A、b mol B和c mol C,要达到t1时刻同样的平衡,a、b、c要满足的条件为______.在体积为2L的密闭容器中,CO与H2在一定条件下反应生成甲醇:
CO(g)+2H2(g)
CH3OH(g).反应达到平衡时,平衡常数表达式K=______,升高温度,K值______(填“增大”、“减小”或“不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______.
向FeS04溶液中滴加NaOH溶液时,首先产生白色沉淀,然后沉淀迅速转变为红褐色沉淀,这是因为发生了反应4Fe(OH)2+2H2O+O2═4Fe(OH)3对于该反应速率的描述正确的是( ) A.在这一反应中,各物质的消耗速率相等 B.若反应中消耗4 mol H2O,则必定同时生成2 mol Fe(OH)3 C.v[Fe(OH)2]=2v(H2O)=4v(O2) D.反应中消耗1 mol O2,必定同时消耗2 mol H2O 某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
(1)该反应第______ 分钟到达平衡状态,X所占的体积分数为______.
(2)该反应的化学方程式为______.
(3)反应开始至2min,气体X的平均反应速率为______.
在相同温度下,下列化学反应速率最慢的是( ) A.10mL 0.1mol/L Na2S2O3+10mL 0.1mol/L H2SO4 B.5mL 0.1mol/L Na2S2O3+5mL 0.1mol/L H2SO4 C.5mL 0.1mol/L Na2S2O3+5mL 0.05mol/L H2SO4 D.10mL 0.05mol/L Na2S2O3+10mL 0.05mol/L H2SO4 在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vC=2vB,则此反应可表示为( ) A.2A+3B=2C B.A+3B=2C C.3A+B=2C D.A+B=C 在mA+nB 
pC的反应中m、n、p为各物质的化学计量数,现测得C每分钟增加aMol/L,B每分钟减小1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为( )A.2:3:2 B.2:2:3 C.1:3:2 D.3:1:2 常温下,分别将四块形状相同且质量均为7g的铁块同时投入下列四种溶液中,产生气体的速率最快的是( ) A.1000mL2mol/LHCl B.500mL4mol/LH2SO4 C.50ml3mol/LHCl D.50mL18.4mol/LH2SO4 关于反应速率的说法中,正确的是( ) A.反应速率用于衡量化学反应进行的快慢 B.决定反应速率的因素是反应温度 C.可逆反应达到化学平衡时,正逆反应速率都为0 D.增大反应物浓度,升高温度都能增大反应速率 甲、乙两个容器内都进行A→B的反应,甲容器内每分钟减少了4molA,乙容器内每分钟减少2molA,则甲容器内的反应速率比乙容器内的反应速率( ) A.快 B.慢 C.相等 D.无法判断 最新试题- 下列各句中,加粗的词语使用不恰当的一项是[ ]A.瑞士国土面积不大,但民族众多,语言也多,法语、德语、意大利语等
- 根据所给中文完成句子(共30空,每空填一词0.5分,满分15分)小题1:他还告诉我们赢得尊重的最佳途径就是专心学习并取得
- 下列图案中是中心对称图形的是( )
- 鱼体中气体和养料以及废物交换的场所是( )A.动脉B.静脉C.心脏D.毛细血管
- 二项式(x-1x)6的展开式中常数项是第______项.(用数字作答)
- 发展改革委在《关于2010年深化经济体制改革工作的意见》中指出,要通过深化改革破解发展难题,通过扩大开放赢得发展机遇。这
- 若……,且(Ⅰ)求值;(Ⅱ)若,求的值
- 已知函数f(x)=3x-1,则f(2)_____.
- 阅读下面的材料,按要求作文。 把握是力量和信心的表现。你多一分努力,就会多一分成功的把握。 把握又是一种积极的行为。
- 材料一:马克思说:“对东印度开始进行的征服和掠夺,非洲变成商业性地猎捕黑人的场所,这一切标志着资本主义生产时代的曙光,
热门考点- 将密度为0.6×103kg/m3,体积120cm3的木块放入盐水中,木块有1/2的体积露出盐水面.则木块受到的浮力为__
- 下列事件是必然事件的是:( )A.抛一枚硬币,正面朝上B.抛一颗骰子,点数不大于6 C.到电影院任意买一张电影票,座位号
- 为下列各句加粗词选出一个恰当的义项[ ]驽马十驾,功在不舍。A.量词;功劳,功勋B.驾驶;工作,事情C.马拉车一
- (2010•河南)在科学晚会上,小亮用一根胶管表演了一个有趣的节目.如图所示,他一只手握住管的中部,保持下半部分不动,另
- 计算 (log29)•(log34)=______.
- 请根据下列实验装置图回答下列问题:(1)请填写标号仪器的名称:①______,②______;(2)实验室中用过氧化氢溶
- 物质的体积一定是22.4L的是( )A.1 mol氧气B.标准状况下44 g二氧化碳C.0℃、2×105 Pa时2 g
- 司机开车上坡前,往往加大油门,以提高车速,这是为了增大汽车的 能.清洁车能通过吸尘器将路面上的垃圾吸入车内容器中,清
- 汉译英。1. Jack总是尽力帮助别人。 Jack always _____ help others.2. 他自学
- Stephen Hawking who can"t walk or even speak is a famous and
© 2017-2019 超级试练试题库,All Rights Reserved.