氧化性和还原性强弱的比较
强弱判定
物质的氧化性是指物质得电子的能力,还原性是指物质失电子的能力。物质氧化性、还原性的强弱取决于物质得失电子的能力(与得失电子的数量无关)。从方程式与元素性质的角度,氧化性与还原性的有无与强弱可用以下几点判定:
(1)从元素所处的价态考虑,可初步分析物质所具备的性质(无法分析其强弱)。最高价态——只有氧化性,如H2SO4、KMnO4中的S、Mn元素;最低价态,只有还原性,如Cl-、S2-等;中间价态——既有氧化性又有还原性,如Fe、S、SO2等。
(2)根据氧化还原的方向判断:氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。
(3)根据反应条件判断:当不同的氧化剂与同一种还原剂反应时,如氧化产物中元素的价态相同,可根据反应条件的高、低进行判断,如是否需要加热,是否需要酸性条件,浓度大小等等。
比较方法
(1)根据氧化还原反应方程式判断
氧化性:氧化剂的氧化性>氧化产物的氧化性
还原性:还原剂的还原性>还原产物的还原性
(2)根据金属(非金属)活动性顺序判断
①金属活动性顺序

②非金属活动性顺序

(3)根据与同一物质反应的难易(条件)判断:
当不同氧化剂作用于同一还原剂时,如氧化产物价态相同,可根据反应条件高低来进行判断。
例:
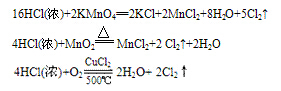
三个反应还原剂都是浓盐酸,氧化产物都是氯气,氧化剂分别是高锰酸钾、二氧化锰、氧气,有反应方程式可得,反应条件越来越难,可得结论:氧化性KMnO4> MnO2> O2
(4)根据氧化产物的价态高低判断
当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态高低来判断氧化剂氧化性的强弱。
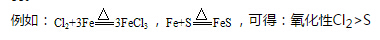
注:不能通过氧化剂化合价降低的多少来判断氧化性的强弱。
(5)根据元素周期表判断
①同周期主族元素从左→右,金属单质还原性逐渐减弱(对应的阳离子的氧化性逐渐增强),非金属单质氧化性逐渐增强(对应的阴离子的还原性逐渐减弱);
同主族元素从上→下,金属单质还原性逐渐增强(对应的阳离子的氧化性逐渐减弱),非金属单质氧化性逐渐减弱(对应的阴离子的还原性逐渐增强)。
注:元素在周期表中越是位于左下方,其单质的还原性越强,其阳离子的氧化性越弱;元素在周期表中越是位于右上方,其单质的氧化性越强,其阴离子的还原性越弱。
(6)根据原电池、电解池的电极反应判断氧化性、还原性的强弱 (根据这个规律也可判断原电池、电解池电极)
①两种不同金属构成原电池的两级:负极:金属电子流出,正极:金属电子流入
还原性:负极>正极
②用惰性电极电解混合溶液时,在阴极先放电的阳离子的氧化性较强,在阳极先放电的阴离子的还原性较强。
(7)根据物质浓度的大小比较:
具有氧化性(或还原性)的物质的浓度越大,其氧化性(还原性)越强,反之,其氧化性(还原性)越弱。例如:氧化性HNO3(浓)>HNO3(稀);还原性 HCl(浓)>HCl(稀)
(8)根据氧化剂、还原剂性质的影响因素判断
①温度:一般温度高氧化剂的氧化性强(浓H2SO4与Cu常温不反应,加热则反应)。
②酸碱性:一般在酸性条件下氧化剂的氧化性增强。如KMnO4在酸性条件下氧化能力更强;KClO3能氧化浓盐酸中的Cl- → Cl2,而不能氧化NaCl中的Cl-;又如在中性溶液中Fe2+与NO3-可共存但在H+存在的条件下Fe2+与NO3-不共存等。
根据下列反应:①2H2S+O2  2S+2H2O ②4NaI+O2+2H2O=4NaOH+2I2 ③Na2S+I2=2NaI+S↓反应中氧化剂的氧化性由强到弱的排列顺序正确的是
2S+2H2O ②4NaI+O2+2H2O=4NaOH+2I2 ③Na2S+I2=2NaI+S↓反应中氧化剂的氧化性由强到弱的排列顺序正确的是[ ]
A.S>I2>O2
B.O2 >S>I2
C.O2 >I2>S
D.I2>O2 >S已知常温下在溶液中可发生如下两个离子反应:Ce4+ + Fe2+ = Fe3++ Ce3+ ,Sn2+ + 2Fe3+ =2Fe2++ Sn4+ 。由此可以确定Fe2+、Ce3+、Sn2+ 三种离子的还原性由强到弱的顺序是 [ ] A.Sn2+ 、Fe2+、Ce3+
B.Sn2+ 、Ce3+ 、Fe2+
C.Ce3+、Fe2+、Sn2+
D.Fe2+、Sn2+ 、Ce3+已知I-、Fe2+、SO2、Cl-、H2O2在酸性溶液中的还原性强弱顺序为:SO2 > I-> H2O2> Fe2+> Cl-,则下列反应不可能发生的是 [ ] A、H2O2+ H2SO4= SO2+ O2+2H2O
B、2I-+2Fe3+= I2+2Fe2+
C、2 Fe3++ SO2 +2H2O= 2Fe2++SO42-+4H+
D、SO2 +2 H2O+ I2= H2SO4+2HI已知:X2、Y2、Z2、W2四种物质的氧化能力W2> Z2>X2>Y2,下列氧化还原反应能发生的是 [ ] A、2NaW+Z2 = 2NaZ+W2
B、2NaX+Z2 = 2NaZ+X2
C、2NaY+W2 = 2NaW+Y2
D、2NaZ+X2 = 2NaX+Z2根据反应:
2P+5Br2+8H2O=2H3PO4+10HBr
Cl2+2HBr=2HCl+Br2
2KMnO4+16HCl(浓) =2KCl+2MnCl2+5Cl2↑+8H2O
(1)推断氧化性(氧化剂)由强到弱的顺序是 。
(2)还原性(还原剂)由强到弱的顺序是 。已知:①2BrO3-+Cl2=Br2+2ClO3- ②5Cl2+I2+6H2O=2HIO3+10HCl ③ClO3-+5Cl-+6H+=3Cl2+
3H2O 下列粒子氧化性强弱顺序正确的是[ ] A. ClO3->BrO3->IO3->Cl2
B. IO3-<ClO3-<BrO3-<Cl2
C. BrO3->ClO3->Cl2>IO3-
D. IO3-<BrO3-<Cl2<ClO3-已知I-、Fe2+、SO2、Cl-、和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2 >I->Fe2+ >H2O2>Cl-,则下列反应不可能发生的是
A、2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+
B、I2 + SO2 + 2H2O = H2SO4 + 2HI
C、2 Fe2+ + I2 =2Fe3+ + 2I-
D、H2O2 + SO2 =H2SO4由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOC12在酸性条件下可以产生C12。下列关于混盐CaOC12的有关判断不正确的是 [ ] A.该混盐与硫酸反应产生1molC12时转移2NA个电子
B.该混盐的水溶液呈碱性
C.该混盐具有较强的氧化性
D.该混盐中氯元素的化合价为+1和-1向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示。
2Fe2++Br2==2Fe3++2Br-,2Fe3++2I-=2Fe2++I2。则下列说法中不正确的是
[ ] A.还原性I-> Fe2+> Br-
B.原混合溶液中FeBr2的物质的量为6mol
C.当通入2molCl2时,溶液中发生的离子反应可表示为:2Fe2++2I-+2Cl2==2Fe3++I2+4Cl-
D.原溶液中:n(Fe2+)︰n(I-)︰n(Br-)=2︰1︰3已知反应2A3++3C==2A+3C2+;3B++A =A3++3B;C2++D = D2++C,则A、B、C、D还原性由强到弱的顺序为_______________________。 根据反应式:(1)2Fe3++2I-=2Fe2++I2,(2)Br2+2Fe2+=2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是 [ ] A.Br-、Fe2+、I-
B.I-、Fe2+、Br-
C.Br-、I-、Fe2+
D.Fe2+、I-、Br-根据下列事实:①X+Y2+=X2++Y;②Z+H2O(冷)=Z(OH)2+H2↑;③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为 [ ] A.X > Z > Y > W
B.Z > W > X > Y
C.Z > Y > X > W
D.Z > X > Y > W已知下述三个实验均能发生化学反应。 
下列判断正确的是 [ ] A.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
B.实验①中铁钉只做还原剂
C.实验②中Fe2+既显氧化性又显还原性
D.实验③中发生的是置换反应下列叙述正确的是 [ ] A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到该元素的单质
C.使用简易布袋代替塑料购物袋,一定程度上可以达到减少环境污染
D.碱金属锂可以保存在煤油里常温下,在下列溶液中发生如下反应:
(1)
(2)
(3)
由此判断,下列说法错误的是[ ] A. 反应  可以进行
可以进行
B. Z元素在(1)(3)反应中均被还原
C. 氧化性由强到弱顺序是
D. 还原性由强到弱顺序是
氯酸质量分数超过40%时会发生分解,反应可表示为:8HClO3=3O2↑+ 2Cl2↑+ 4HClO4+2H2O,下列说法正确的是 [ ] A.氧化性比较HClO4>HClO3
B.氧化产物只有HClO4
C.氯酸分解后的混合气体平均相对分子质量为47.6
D.该反应转移电子数为12e-常温下,在溶液中可以发生反应:X+2Y3+=2Y2++X2+,则下列叙述①X被氧化;②X是氧化剂;③X具有还原性;④Y2+是氧化产物;⑤Y2+具有还原性;⑥Y3+的氧化性比X2+的氧化性强。以下叙述中正确的是 [ ] A.②④⑥
B.①③④
C.①③⑤⑥
D.②⑤根据下列三个反应的化学方程式,判断有关物质的还原性强弱顺序 [ ] ①I2+SO2+2H2O=H2SO4+2HI ②2FeCl2+Cl2=2FeCl3 ③2FeCl3+2HI=2FeCl2+2HCl+I2
A.I->Fe2+>Cl->SO2
B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2
D.SO2>I->Fe2+>Cl-根据下列反应判断有关物质还原性由强到弱的顺序是 [ ] ①H2SO3+I2+H2O=2HI+H2SO4 ②2FeCl3+2HI=2FeCl2+2HCl+I2
③3FeCl2+4HNO3=2FeCl2+NO↑+2H2O+Fe(NO3)2
A.H2SO3>I->Fe2+>NO
B.I->Fe2+>H2SO3>NO
C.Fe2+>I->H2SO3>NO
D.NO>Fe2+>H2SO3>I-根据下列反应:
(1)2Fe3+ + 2I- = 2Fe2+ + I2
(2)2MnO4- + 16H+ +10Cl- = 2Mn2+ + 5Cl2↑ + 8H2O
(3)2Fe2+ + Cl2 = 2Fe3+ + 2Cl-
若要从含有Cl-、I-、Fe2+的混合液中,只除去I-,而Fe2+和Cl-不被氧化,则应向混合溶液中加入[ ] A.KMnO4
B.Cl2
C.FeCl2
D.FeCl3已知:2BrO3-+Cl2=Br2+2ClO3-;5Cl2+I2+6H2O=2HIO3+10HCl;ClO3-+5Cl-+6H+=3Cl2+3H2O。依据上述方程式,下列微粒氧化能力顺序正确的是 [ ] A.ClO3->BrO3->IO3->Cl2
B.BrO3->Cl2>ClO3->IO3-
C.BrO3->ClO3->Cl2>IO3-
D.Cl2>BrO3->ClO3->IO3-氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为
aHClO3= bO2↑+ cCl2↑+ dHClO4 + eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色。下列说法正确的是[ ] A.由反应可确定:氧化性HClO4>HClO3
B.变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5C12 + I2 + 6H2O = 12H+ + 10Cl- + 2IO3-
C.若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示为:
26HClO3 = 15O2↑+ 8C12↑+ 10HClO4 + 8H2O
D.若化学计量数a=8,b=3,则该反应转移电子数为12e-有下列三个氧化还原反应:①2FeCl3+2KI=2KCl+2FeCl2+I2,②2FeCl2+Cl2=2FeCl3,③2KMnO4+
16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 若某溶液中Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和
Cl-,可加入的试剂是[ ] A.Cl2
B.KMnO4
C.FeCl3
D.HCl根据下列反应判断有关物质的还原性由强到弱的顺序正确的是
①H2SO3+I2+H2O=2HI+H2SO4
②2FeCl3+2HI=2HCl+2FeCl2+I2
③3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3[ ] A.H2SO3 > I- > Fe2+ > NO
B.I- > H2SO3 > Fe2+ > NO
C.Fe2+ > I- > H2SO3 > NO
D.NO > Fe2+ > H2SO3 > I-下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2 MnCl2 +Cl2↑+2H2O
MnCl2 +Cl2↑+2H2O
②4HCl(g)+O2 2Cl2+2H2O(g)
2Cl2+2H2O(g)
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
则三种氧化剂由强到弱的顺序是[ ] A.O2 > MnO2 > KMnO4
B.KMnO4 > MnO2 >O2
C.MnO2> KMnO4 >O2
D.O2> KMnO4> MnO2著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土串级萃取理论方面作出的贡献。稀土铈(Ce)元素主要存在于独居石中,金属铈在空气 中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+,则下列说法中正确的是 [ ] A.铈的冶炼方法为:用稀土串级萃取法对矿石进行萃取富集;然后电解熔融的CeO2
B.CeO2溶于氢碘酸的化学方程式可表示为:CeO2+4HI=CeI4+2H2O
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.四种稳定的核素13658Ce、13858Ce、14058Ce、14258Ce,它们互称为同位素已知常温下,在溶液中可发生如下反应:Ce4+ + Fe2+ = Fe3+ + Ce3+, Sn2+ + 2Fe3+ = 2Fe2+ + Sn4+。由此推断Fe2+、Ce3+、Sn2+的还原性由强到弱的顺序是 [ ] A.Sn2+、Fe2+、Ce3+
B.Fe2+、Ce3+、Sn2+
C.Fe2+、Sn2+、Ce3+
D.Ce3+、Fe2+、Sn2+已知Co2O3在酸性溶液中易被还原成Co2+,且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列叙述中,正确的是 [ ]
A.Cl2通入FeI2溶液中,可存在反应3Cl2+6FeI2==2FeCl3+4FeI3
B.每1mol Co2O3在酸性溶液中被氧化生成Co2+时转移2mol e-
C.FeCl3溶液能使淀粉-KI试纸变蓝
D.I2是ⅦA族元素单质,具有较强的氧化性,可以将Co2+氧化成Co2O3已知:① 向KMnO4晶体滴加浓盐酸,产生黄绿色气体;② 向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③ 取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝。下列判断正确的为 [ ] A.上述实验证明氧化性:MnO4->Cl2>Fe2+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性向含有Cu(NO3)2、Zn(NO3)2、Fe(NO3)3、AgNO3各0.1 mol的混合溶液中加入0.1 molFe,充分搅拌后Fe溶解,溶液中不存在Fe3+,同时析出0.1 mol Ag。下列结论错误的是 A.氧化性:Zn2+>Cu2+>Fe3+>Ag+
B.Fe3+的氧化性大于Cu2+
C.溶液中Cu2+与Fe2+的物质的量比为1∶2
D.1mol Fe可还原2mol Fe3+已知下列反应:
①2BrO3-+Cl2=Br2+2ClO3-
②5Cl2+I2+6H2O=2HIO3+10HCl
③ClO3-+5Cl-+6H+= 3Cl2+3H2O
判断下列物质氧化能力强弱顺序正确的是[ ] A.ClO3->BrO3->IO3->Cl2
B.ClO3->BrO3->Cl2>IO3-
C.BrO3->ClO3->Cl2>IO3-
D.Cl2>BrO3->ClO3->IO3-已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<
I-<SO2,则下列反应中不能发生的是[ ] A.H2O2 + H2SO4 ══ SO2 ↑ + O2 ↑ + 2H2O
B.I2 + SO2 + 2H2O ══ H2SO4 + 2HI
C.2Fe2+ + Cl2 ══ 2Fe3+ + 2Cl-
D.2Fe3+ + SO2 + 2H2O ══ 2Fe2+ + SO42-+ 4H+已知有如下反应:①2BrO3-+Cl2=Br2+2ClO3-,②ClO3-+5Cl-+6H+==3Cl2+3H2O,③2FeCl3+2KI==2FeCl2+
2KCl+I2,④2FeCl2+Cl2==2FeCl3。下列叙述正确的是[ ] A.氧化能力:ClO3->BrO3->Cl2>Fe3+>I2
B.还原能力:Fe2+> I- >Cl-
C.反应ClO3-+Br- =Cl- + BrO3-能顺利进行
D.氧化能力:BrO3->ClO3->Cl2>Fe3+>I2今有三个氧化还原反应:①2FeCl3+2KI == 2FeCl2+2KCl+I2;②2FeCl2+Cl2 == 2FeCl3;③2KMnO4+16HCl
== 2KCl+2MnCl2+5Cl2↑+8H2O。若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-。可加入的试剂是[ ]
A.Cl2
B.KMnO4
C.FeCl3
D.HClR、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;
Y+Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合[ ] A.R2+>X2+>Z2+>Y2+
B.X2+>R2+>Y2+>Z2+
C.Y2+>Z2+>R2+>X2+
D.Z2+>X2+>R2+>Y2+根据反应式:①2Fe3++2I-=2Fe2++I2 ②2Fe2++Br2=2Fe3++2Br-,可判断离子的还原性从强到弱的顺序是 [ ] A.Br->Fe2+>I-
B.I->Fe2+>Br-
C.Br->I->Fe2+
D.Fe2+>I->Br-在一定条件下,下列微粒的还原性顺序为Cl-<Br-<Fe2+<I-<SO2,由此判断以下各反应在溶液中不能发生的是 [ ] A.2Fe3+ + SO2 + 2H2O == 2Fe2+ + SO42-+ 4H+
B.2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
C.2Br-+4H+ + SO42-== SO2 + Br2 + 2H2O
D.I2 + SO2 + 2H2O == 4H+ +SO42- + 2I-高铁酸钠(Na2FeO4)是一种新型净水剂,可以对饮用水进行消毒和净化。工业上常通过如下方法制取:3NaNO3+Fe2O3+4NaOH=2Na2FeO4+3NaNO2+2H2O,下列有关说法正确的是 [ ] A.Fe2O3是氧化剂
B.Na2FeO4既是氧化产物又是还原产物
C.生成1mol Na2FeO4时,有3mol电子转移
D.Na2FeO4能***菌消毒是利用Na2FeO4中+6价铁的强氧化性被还原为Fe3+,净水是利用Fe3+根据下列化学方程式:2FeCl3+2KI=2FeCl2+2KCl+I2,2FeCl2+Cl2=2FeCl3,2KMnO4+16HCl=2MnCl2+5Cl2↑+8H2O+2KCl,判断各物质氧化性由大到小的顺序正确的是 [ ] A.I2>Cl2>FeCl3>KMnO4
B.KMnO4 >Cl2>FeCl3>I2
C.Cl2>I2>FeCl3>KMnO4
D.FeCl3>KMnO4>Cl2>I2常温下,在下列溶液中发生如下反应 
由此判断,下列说法错误的是 [ ] A.反应  可以进行
可以进行
B. Z元素在(1)(3)反应中均被还原
C.氧化性由强到弱顺序是
D.还原性由强到弱顺序是
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写)
(2)整个过程中的还原剂是_____________。
(3)把KI换成KBr,则CCl4层变为_____________色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、
HIO3、HBrO3氧化性由强到弱的顺序是_____________。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若KI与Cl2反应制KIO3,至少需要消耗Cl2__________L(标准状况,保留2位小数)。常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3++2H2O,
2Fe3++H2O2=2Fe2++O2↑+2H+下列说法正确的是[ ] A.H2O2的氧化氢比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是____________。
(2)已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式为____________。
(3)根据上述反应可推知___________。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3 c.还原性:AsH3>X d.还原性:X>AsH3 (4)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,并标出电子转移的方向和数目
在KI和硫酸的混合溶液中加入过氧化氢水溶液,迅速发生反应放出大量气体,反应过程如下:
①H2O2+2KI+H2SO4=I2+K2SO4+2H2O
②H2O2+I2=2HIO
③H2O2+2HIO=I2+O2↑+2H2O
(1)H2O2在反应③中的作用是_____________
A.氧化剂 B.既是氧化剂,也是还原剂 C.还原剂 D.既不是氧化剂,也不是还原剂
(2)有人认为上述反应说明了碘单质是过氧化氢分解的催化剂,你认为__________(填“对”或“不对”),其理由是__________。
(3)上述反应说明H2O2、I2、HIO氧化性从强到弱的顺序是__________________。根据下列事实,判断离子的氧化性顺序为①A+B2+==A2++B ②D+2H2O==D(OH)2+H2↑ ③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+ [ ]
A.D2+>A2+>B2+>E2+
B.D2+>E2+>A2+>B2+
C.E2+>B2+>A2+>D2+
D.A2+>B2+>D2+>E2+常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:2Fe2++H2O2+2H+=2Fe3+ +2H2O
2Fe3+ +H2O2 =2Fe2+ +O2↑+2H+ 下列说法正确的是[ ] A.H2O2的氧化性比Fe3+强,其还原性比Fe2+弱
B.在H2O2分解过程中,溶液的pH逐渐下降
C.在H2O2分解过程中,Fe2+和Fe3+的总量保持不变
D.H2O2生产过程要严格避免混入Fe2+已知:① A+ B2+ = A2++B ,② D +2H2O = D(OH)2 + H2↑,③ 以B 、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E ,B-2e-=B2+。则A2+、B2+、D2+、E2+ 的氧化性强弱关系是 [ ] A.D2+>A2+>B2+>E2+
B.E2+>B2+>A2+>D2+
C.D2+>E2+>A2+>B2+
D.A2+>B2+>D2+>E2+下图是三种稀酸对Fe - Cr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是 
[ ] A.稀硝酸对Fe - Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe +6HNO3(稀) =Fe( NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe - Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硝酸对Fe - Cr合金的腐蚀性减弱已知:①X+Y2+ = X2++Y;②Z+2H2O(冷水)= Z(OH)2+H2↑;③Z2+的氧化性比X2+弱;④由Y、W和稀硫酸组成的原电池的电极反应式为:2H++2e- = H2↑,Y- 2e- =Y2+。由此可知X、Y、W、Z的还原性由强到弱的顺序是 [ ] A.X>Z>Y>W
B.Z>W>X>Y
C.Z>X>Y>W
D.Z>Y>X>W
- 不等式组的解集在数轴上应表示为[ ]A.B.C.D.
- 已知同一平面上的向量,,,满足如下条件:①;②;③,则的最大值与最小值之差是( )A.1B.2 C.4D.8
- 材料一:近年来猪肉价格上涨已成为全国趋势,据新华社全国农副产品和农资价格行情系统监测,与6月13日至19日相比,6月20
- 培养细菌真菌的方法包括配制培养基、______、______和恒温培养.
- 不等式(m2-2m-3)x2-(m-3)x-1<0对一切x∈R恒成立,求实数m的取值范围.
- 第4小题中硅酸的化学式为H2SiO3判断硅酸中硅元素的化合价为( )A.+2B.+4C.+6D.-4
- 下列成语所反映的史实与楚庄王参与争霸有关的是[ ]A.退避三舍B.问鼎中原C.卧薪尝胆D.围魏救赵
- 用分析法证明:若a>0,则
- 【题文】设是定义在上的奇函数,当时,,则的图像与圆的公共点的个数是( &#
- 如图R1和R2是材料相同、厚度相同、表面为正方形的导体,正方形的边长之比为2:1.通过这两导体的电流方向如图所示,则这两
- 在ΔABC中,顶点A,B, C所对三边分别是a,b,c已知B(-1, 0), C(1, 0),且b,a, c成等差数列.
- 一物体作匀加速直线运动,通过一段位移△x所用的时间为T,紧接着通过下一段位移△x所用时间为T2.则物体运动的加速度为(
- —Listen! Is that Kate playing the piano in the room?—No. It
- 下列各句中加粗的词语,使用恰当的一句是[ ]A.戴骁军冒天下之大不韪,曝光了山西霍宝干河煤矿给记者发“封口费”的
- 计算 -72+2×(-3)2+(-6)÷(-)2
- A、B、C、D、E、F、G是初中化学常见的物质,B是一种氧化物,相对分子质量为44,B中两元素质量比为3:8;人体胃酸中
- 1929年发生在美国的经济危机很快波及其他主要资本主义国家,主要是因为[ ]A.资本主义世界市场的确立B.资本主
- 若点(-2,2)到直线3x+4y+c=0的距离为3,求c的值.
- 完形填空。 He has been called the "missing link." Half-man,ha
- 在显微镜下观察临时装片时,见物像偏上、偏右,为使物像放正中,应将装片A.往下、往右移B.往上、往右移C.往下、往左移D.
© 2017-2019 超级试练试题库,All Rights Reserved.
 ;②
;② ;
;  试判断下列物质的氧化性强弱顺序正确的是
试判断下列物质的氧化性强弱顺序正确的是


