中和热
影响中和热测定的因素
中和反应巾放出的热量为(m1+m1)·c·(t1-t2),其巾溶液的比热容c是已知的,对于给定的反应物的质量m1和m2也是定值,这样求算出的中和热是否接近 57.3kl·mol-1,取决于溶液温度的变化。
在整个实验过程中应把好两关:①隔热关。如:小烧杯周围的泡沫塑料要填满;盖板上两孔只要正好使温度计和环形玻璃搅拌棒通过即可;倒人NaOH溶液要迅速等,尽可能减少实验过程中热量的散失。②准确关。如:配制溶液的浓度要准;NaOH溶液要新制,因为久置的NaOH溶液可能变质导致浓度不准;量取液体体积时读数要准;对溶液温度要读到最高点。
注意事项
(1)这里的溶液一般要求是稀溶液,这是因为浓酸溶液和浓碱溶液相互稀释时会放出热量
(2)强酸与强碱的反应实质是H+和OH-反应(即与酸、碱的种类无关),通过多次实验测定,1molH+和1molOH-反应生成lmol H2O(l)时,放出的热量为 57.3kJ
(3)中和热是以生成1molH2O为基准的,因此表示中和热的热化学方程式中,水的化学计量数为1,酸、碱的化学计量数可以为分数
内容
在稀溶液中,酸和碱发生中和反应生成1molH2O时的反应热。中和热的表示方法: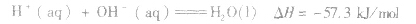
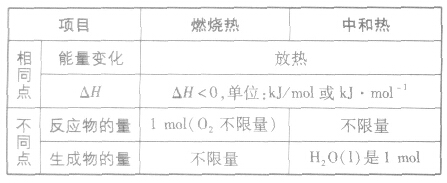
燃烧热和中和热的异同
下列说法中正确的是 [ ] A.1 mol强酸与1mol强碱发生中和反应所放出的热量叫做中和热
B.用渗析法可除去鸡蛋白溶液中少量的氯化钠杂质
C.铝粉与氧化铁粉末反应中生成物总能量高于反应物总能量
D.H2S的热稳定性小于H2O是由于H2S分子间不存在氢键关于化学能与热能的叙述,正确的是 [ ] A.1mol酸与碱恰好中和时所放出的热量叫中和热
B.化学反应中的能量变化,主要是由化学键的变化引起的
C.需要加热才能发生的反应,一定是吸热反应
D.反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应已知中和热的数值是57.3KJ/mol。下列反应物混合时,产生的热量等于57.3KJ的是 [ ] A.1mol/L稀HCl(aq)和1mol/L稀NaOH(aq)
B.500mL2.0mol/L的HCl(aq)和500mL2.0mol/L的NaOH(aq)
C.500mL2.0mol/L的CH3COOH(aq)和500mL2.0mol/L的NaOH(aq)
D.1mol/L稀CH3COOH(aq)和1mol/L稀NaOH(aq)已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g) △H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1) △H2=-57.3kJ/mol
下列结论正确的是[ ] A.若碳的燃烧热用△H3来表示,则△H3<△H1
B.若碳的燃烧热用△H3来表示,则△H3>△H1
C.浓硫酸与稀NaOH溶液反应的中和热为57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量1.00L 1.00mol·L-1 H2SO4溶液与2.00L 1.00mol·L-1 NaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________,表示其中和热的热化学方程式为____________________。 强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l) △H=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为
△H1、△H2、△H3,下列关系正确的是[ ] A.△H1>△H2>△H3
B.△H1<△H2<△H3
C.△H1>△H2=△H3
D.△H1=△H2<△H3依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_____________________________
(2)1.00L 1.00mol/L H2SO4溶液与2.00L 1.00mol/LNaOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为___________,表示其中和热的热化学方程式为____________________。
(3)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与
H2反应生成NH3的热化学方程式为_____________________下列关于热化学反应的描述中正确的是 [ ] A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)
kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热下列关于热化学反应的描述中正确的是 A.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热下列说法正确的是 [ ] A.中和热一定是强酸跟强碱反应放出的热量
B.1mol酸与1mol碱完全反应放出的热量是中和热
C.在稀溶液中,酸与碱发生中和反应生成1 mol H2O时的反应热叫做中和热
D.表示中和热的离子方程式为:H+(aq)+OH-(aq)=H2O(l); △H=57.3KJ/mol强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3 kJ/mol,向1 L 0.5 mol/L的NaOH溶液中加入稀醋酸、浓H2SO4、稀HNO3,则恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是 [ ] A.ΔH1>ΔH2>ΔH3
B.ΔH1<ΔH3<ΔH2
C.ΔH2>ΔH1>ΔH3
D.ΔH1>ΔH3>ΔH2已知101KPa时的辛烷的燃烧热为5518kJ/mol,强酸与强碱在稀溶液中发生反应时的中和热为57.3kJ/mol,则下列热化学方程式书写正确的是 [ ] ①C8H18(l)+ 25/2O2(g)= 8CO2(g)+ 9H2O(l); △H = +5518kJ/mol
②C8H18(l)+ 25/2O2(g)= 8CO2(g)+ 9H2O(l); △H = -5518kJ/mol
③H+(aq)+ OH-(aq)= H2O(l); △H = -57.3kJ/mol
④1/2H2SO4(aq) + NaOH(aq) =1/2Na2SO4(aq) + H2O(l); △H = +57.3kJ/mol
A.①③
B.②③
C.②④
D.②已知中和热的数值是57.3KJ/mol。下列反应物混合时,产生的热量等于57.3KJ的是 [ ] A.1mol/L稀HCl(aq)和1mol/L稀NaOH(aq)
B.500mL2.0mol/L的HCl(aq)和500mL2.0mol/L的NaOH(aq)
C.500mL2.0mol/L的CH3COOH(aq)和500mL2.0mol/L的NaOH(aq)
D.1mol/L稀CH3COOH(aq)和1mol/L稀NaOH(aq)已知中和热的数值是57.3 kJ·mol-1。下列物质反应时能产生57.3 kJ热量的是 [ ] A.稀HCl和稀NaOH溶液
B.1.0 mol·L-1HCl溶液和1.0 mol·L-1NaOH溶液
C.500 mL 2.0 mol·L-1HC1溶液和500 mL 2.0 moI.·L-1 NaOH溶液
D.500 mL 2.0 mol·L-1H2SO4溶液和500 mL 2.0 moI·L-1Ba(OH)2溶液下列有关H+(aq)+ OH-(aq)=H2O(l);△H=-57.3kJ/mol的离子反应说法正确的是 [ ] A.代表所有的酸碱中和反应
B.反应物一定是强酸与强碱
C.强酸与强碱的中和反应都可以这样表示
D.代表稀的强酸与稀的强碱反应生成1mol液态水时,放出热量57.3kJ已知反应:
①101kPa时,2C(s)+O2(g)=2CO(g);△H=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol
下列结论正确的是[ ] A. 碳的燃烧热大于110.5kJ/mol
B. ①的反应热为221kJ/mol
C. 稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D. 稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量下列各项表述正确的是 [ ] A.次氯酸的电子式: 
B.表示中和热的热化学方程式:NaOH(aq)+HF(aq)=NaF(aq)+H2O(l);△H=-57.3kJ/mol
C.H2S电离的方程式为:H2S 2H++S2-
2H++S2-
D.标准状况下,1.12L 和1.12L
和1.12L 均含有0.1
均含有0.1 个氧原子
个氧原子 已知:HCN(aq)与NaOH(aq)反应的△H=-12.1 kJ/mol;HClcaq)与NaOH(aq) 反应的△H=-55.6kJ/mol。则
HCN在水溶液中电离的△H等于[ ] A. -43.5kJ/mol
B. +43.5kJ/mol
C. -67.7 kJ/mol
D. +67.7kJ/mol下列说法正确的是 [ ] A.HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3) kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0 kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热下列关于热化学反应的描述中正确的是 [ ] A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
B.CO(g)的燃烧热是283. 0kJ/mol,则2CO2(g)=2CO(g)+O2(g) 反应的△H =2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热下列说法或表示方法正确的是 [ ] A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.由C(金刚石,s)=C(石墨,s) △H=-1. 90kJ/mol可知,金刚石比石墨稳定
C.氢气的燃烧热285. 8kJ/mol,氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(l) △H=+285. 8kJ/mol
D.在稀溶液中H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol。若将含0. 5mol H2SO4的浓溶液与含1mol NaOH的溶液混合,放出的热量大于57.3kJ强酸和强碱稀溶液的中和热表示为H+(aq)+OH-(aq)=H2O(l) △H= -57. 3kJ·mol-1 已知:
①HCl(aq) +NH3·H2O(aq)=NH4Cl(aq)+H2O(l) △H=-akJ·mol-1
②HCl(aq) +NaOH( s)=NaCl(aq) +H2O(l) △H=-bkJ·mol-1
③HNO3(aq) +NaOH(aq)=NaNO3(aq) +H2O(l) △H=- ckJ·mol-1
则a、b、c三者的大小关系为[ ] A.a>b>c
B.b>c>a
C.a=b=c
D.无法比较在量热计(如下图所示)中将l00cm3、0. 500mol·L-1 CH3COOH溶液与100cm3、0. 500mol·L-1 NaOH溶液混合,温度从298.16K升高到300. 71K。已知量热计的热容常数(量热计各部件每升高1K所需的热量)是150. 5J·K-1,CH3COONa溶液比热容为4.03J·g-1·K-1,溶液的密度为0. 963g·cm-3。 
(1)试求CH3COOH的中和反应的反应热△H为____kJ·mol-1。
(2)CH3COOH的中和热的文献值为56. 1kJ·mol-1,请你分析(1)中测得的实验值偏差的可能原因是____。
(3)已知HCl( aq) +NaOH (aq)=NaCl(aq) +H2O(l) △H=- 57. 3kJ.mol-1;现有①CH3COOH、②浓H2SO4、
③HNO3与NaOH溶液反应的反应热分别为 △H1、△H2、△H3,则△H1、△H2、△H3三者的大小关系为___。下列说法或表示方法正确的是 [ ] A.在稀溶液中,H+(aq)+ OH-(aq)= H2O(l) △H =-57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热大于57.3 kJ
B.由C(石墨)= C(金刚石) △H = +1.90 kJ/mol可知金刚石比石墨稳定
C.相同温度下,①pH=5的NH4Cl溶液、② pH=4的稀盐酸中由水电离出的c (H+):①<②
D.pH=5.6的CH3COOH与CH3COONa混合溶液中:c(Na+) > c(CH3COO-)(1)稀强酸、稀强碱反应生成1mol水时放出57.3 kJ的热。
① 实验室中可用稀盐酸和氢氧化钡稀溶液反应来测定中和热。请写出能表示该反应中和热的热化学方程式_________________;
② 分别取100 mL 0.50 mol/L盐酸与100 mL 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是1g/cm3,中和后生成溶液的比热容c= 4.18 J/(g·℃)。实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃。则实验测得的中和热△H=_______(保留1位小数)
③ 如果用含1 mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热____57.3 kJ(填“大于”、“小于”或“等于”);理由是_____________________________;
(2)在催化剂的作用下CH4还原NO可以得到三种产物(该条件下均为气体),利用此反应能消除环境污染物NO。理论上每消耗标况下22.4 L NO就能放出290 kJ的热。写出该反应的热化学方程式
_____________________。强酸和强碱稀溶液的中和热可表示为: H+(aq)+OH-(aq)=H2O(l) △H=-57.3 kJ·mol-1 已知:
CH3COOH( aq)+NaOH( aq) =CH3 COONa(aq)+ H2O(l) △H1
H2SO4(浓)+NaOH(aq)=Na2SO4(aq)+H2O(l) △H2
HNO3( aq)+ KOH( aq)=KNO3(aq)+ H2O(l) △H3
上述反应均为在溶液中的反应,则△H1、△H2、△H3的关系正确的是[ ] A.△H1=△H2=△H3
B.△H2>△H3>△H1
C.△H2<△H3< △H1
D.△H2=△H3<△H1H2SO4溶液和KOH溶液反应时有热量放出,并已知反应物的总能量为E1,生成物的总能量为E2。试回答下列问题:
(1)用离子方程式表示中和反应的实质:___。
(2)判断E1和E2的大小关系:E1____E2。
(3)已知H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol,计算下列中和反应中放出的热量。
①用20g NaOH配成稀溶液跟足量的稀盐酸反应,能放出 ___kJ的热量。
②用0. 1mol Ba(OH)2配成稀溶液跟足量的稀硝酸反应,能放出___kJ的热量。强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1) ⊿H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应⊿H1、⊿H2、⊿H3的关系正确的是 [ ] A.⊿H1>⊿H2>⊿H3
B.⊿H1<⊿H3<⊿H2
C.⊿H1<⊿H2<⊿H3
D.⊿H1>⊿H3>⊿H2关于化学能与热能的叙述,正确的是 [ ] A.1mol酸与碱恰好中和时所放出的热量叫中和热
B.化学反应中的能量变化,主要是由化学键变化引起的
C.需要加热才能发生的反应,一定是吸热反应
D.反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应已知:H+(aq) + OH-(aq) → H2O(l) + 57.3 kJ。对于下列反应:
①HCl(aq) + NH3 H2O(aq) → NH4Cl(aq) + H2O(l) + a kJ
H2O(aq) → NH4Cl(aq) + H2O(l) + a kJ
②HCl(aq) + NaOH(s) → NaCl(aq) + H2O(l) + b kJ
③HNO3(aq) + KOH(aq) → KNO3(aq) + H2O(l) + c kJ
则a、b、c三者的大小关系为[ ] A.a>b>c
B.b>c>a
C.a=b=c
D.无法比较已知:①H+(aq)+OH-(aq)==H2O(l);ΔH1;②2SO2(g)+O2(g)  2SO3(g);ΔH2。其他条件不变时,改变反应物的量,则下列判断正确的是
2SO3(g);ΔH2。其他条件不变时,改变反应物的量,则下列判断正确的是[ ] A.ΔH1增大,ΔH2减小
B.ΔH1增大,ΔH2增大
C.ΔH1减小,ΔH2减小
D.ΔH1不变,ΔH2不变强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol。向1L0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应时的热效应的△H1、△H2、△H3,关系正确的是 [ ] A.△H1>△H3>△H2
B.△H1<△H2<△H3
C.△H1>△H2=△H3
D.△H1=△H2<△H3下列关于中和热的说法不正确的是 [ ] A.发生酸碱中和反应时所放出的热量叫中和热
B.中和反应的实质是H+ 与OH-结合生成水,若有其它物质生成,这部分反应热不在中和热内
C.在稀溶液中,酸跟碱发生中和反应生成1mol水时所放出的热量称为中和热
D.中和热不包括物质溶解、电离、水合等过程中的热效应中和反应是典型的放热反应,酸与碱发生中和反应生成1mol水时所释放的热量称为中和热。下列关于中和热的说法正确的是 [ ] A.中和反应生成盐和水的总能量高于酸和碱的总能量
B.稀盐酸和氢氧化钠固体反应生成1mol水释放的热量即为中和热
C.稀硫酸和氢氧化钡溶液反应生成1mol水释放的热量即为中和热
D.中和热的测定实验中应尽量防止反应中的热量损失中和反应是典型的放热反应,酸与碱发生中和反应生成1mol水时所释放的热量称为中和热。下列关于中和热的说法正确的是 [ ] A.中和反应生成盐和水的总能量高于酸和碱的总能量。
B.稀盐酸和氢氧化钠固体反应生成1mol水释放的热量即为中和热。
C.稀硫酸和氢氧化钡溶液反应生成1mol水释放的热量即为中和热。
D.中和热的测定实验中应尽量防止反应中的热量损失。下列说法或表示方法正确的是 [ ] A.反应物的总能量低于生成物的总能量时,该反应一定不能发生
B.强酸跟强碱反应放出的热量一定是中和热
C.由石墨比金刚石稳定可知:C(金刚石,s)===C(石墨,s) ΔH<0
D.在101 kPa、25℃时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)===2H2O(l) ΔH=-285.8 kJ/mol已知反应:①101 kPa时,2C(s)+O2(g)===2CO(g) ΔH=-221 kJ/mol ②稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.4 kJ/mol 下列结论正确的是 [ ] A.炭的燃烧热大于110.5 kJ/mol
B.①的反应热为221 kJ/mol
C.稀硫酸与稀氢氧化钠溶液反应的中和热为-57.4 kJ/mol
D.稀醋酸与稀氢氧化钠溶液反应生成1 mol水,放出57.4 kJ热量已知:H+(aq) + OH-(aq) = H2O(l) △H =-57.3 kJ·mol-1。对于下列反应:
①HCl(aq) + NH3·H2O(aq) = NH4Cl(aq) + H2O(l) △H =-a kJ·mol-1
②HNO3(aq) + KOH(aq) = KNO3(aq) + H2O(l) △H =-b kJ·mol-1 则a、b的大小关系为[ ] A.a>b
B.b>a
C.a = b
D.无法比较强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时热效应分别为△H1、△H2、△H3,它们的关系正确的是( ) A.△H1>△H2>△H3 B.△H1<△H3<△H2 C.△H1=△H2=△H3 D.△H2<△H3<△H1 强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H2O;△H=-57.3kJ/mol.分别向1L 0.5mol/L的NaOH溶液中加入:①稀醋酸;②浓H2SO4;③稀硝酸,恰好完全反应时的热效应分别为△H1、△H2、△H3,它们的关系表示正确的是( ) A.△H2<△H3<△H1 B.△H1>△H2>△H3 C.△H1=△H2=△H3 D.△H2>△H3>△H1 下列说法或表示方法正确的是( ) A.反应物的总能量低于生成物的总能量时,该反应一定不能发生 B.强酸跟强碱反应放出的热量一定是中和热 C.由石墨比金刚石稳定可知:C(金刚石,s)=C(石墨,s),△H<0 D.在101kPa、25°C时,1gH2完全燃烧生成气态水,放出120.9kJ热量,则氢气的燃烧热为241.8kJ/mol 在用HCl和NaOH进行中和热测定实验中,若其他条件不变,用氨水代替NaOH,则会使测定结果△H( ) A.偏大 B.偏小 C.不变 D.无法判断 下列说法正确的是( ) A.酸与碱发生中和反应所放出的热量称为中和热 B.化学反应中能量变化的大小与反应物的质量多少无关 C.由1H、2H、3H、35Cl、37Cl组成的氯化氢分子有6种 D.O2与O3的相互转化是物理变化 下列中和反应中放出热量最多的是( ) A.100mL0.3mol/L的HCl和50mL0.3mol/L的NaOH相混合 B.80mL0.3mol/L的HCl和80mL0.3mol/L的NaOH溶液相混合 C.80mL0.3mol/L的H2SO4和80mL0.3mol/L的NaOH溶液相混合 D.50mL0.3mol/L的H2SO4和50mL0.6mol/L的NaOH溶液相混合 下列关于反应能量的说法正确的是( ) A.若反应A(s)=B(s),△H<O,则说明A物质比B物质稳定,分子内共价键键能A比B大 B.Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s);△H=-216kJ•mol-1.则反应物总能量>生成物总能量 C.101kPa时,2H2(g)+O2(g)═2H2O(g);△H=-QkJ•mol-1,则H2的燃烧热为
QkJ•mol-l1 2 D.H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ•mol-1,含1mol NaOH的氢氧化钠溶液与含0.5mol H2SO4的浓硫酸混合后放出57.3kJ的热量 下列过程都与热量变化有关,其中表述不正确的是( ) A.CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)燃烧反应的热化学方程式为CO(g)+
O2(g)═CO2(g);△H=-283.0kJ/mol1 2 B.稀盐酸和稀氢氧化钠溶液反应的中和热为57.3kJ/mol,则表示稀硫酸与稀氢氧化钾溶液发生反应的热化学方程式为
H2SO4(l)+KOH(l)═1 2
K2SO4(l)+H2O(l);△H=-57.3kJ/mol1 2 C.铝热反应是放热反应,但需要足够的热量才能使反应发生 D.水的电离过程是吸热过程,升高温度,水的离子积增大、pH减小 已知:①氯气、单质硫分别跟氢气反应的热化学方程式如下:
H2(g)+Cl2(g)=2HCl(g);△H1=-Q1 kJ/mol H2(g)+S(s)=H2S(g);△H2=-Q2kJ/mol②25℃,10l kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol 下列说法正确的是( )A.氢气的燃烧热为:QlkJ/mol B.Ql>Q2 C.氯气与硫化氢气体反应的热化学方程式:Cl2(g)+H2S(g)=2HCl(g)+S(s);△H2=-(Q2一Q1)kJ/mol D.KOH(aq)+HCl(g)=KCl(aq)+H2O(1);△H=-57.3kJ/mol (1)已知20.0gNaOH稀溶液跟足量稀盐酸反应,放出28.68kJ热量,那么此反应数据表明:如果NaOH稀溶液跟稀盐酸中和生成18g水时,该反应放出热量______kJ,由此测得的中和热为______kJ/mol.
(2)已知断开1molH-H键、1mol Br-Br键、1mol H-Br键分别需要吸收的能量为436kJ、193kJ、366kJ. 计算H2和Br2反应生成1mol HBr需______(填“吸收”或“放出”)能量______kJ.已知:醋酸是弱酸,其电离过程的△H>0,而强酸与强碱的稀溶液发生中和反应的热效应:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kI/mol,向1L 0.5mol/L的NaOH溶液中加入下列物质:①稀醋酸;②浓硫酸;③稀硝酸,恰好完全反应时的反应热△H1、△H2、△H3的关系正确的是( )